Краткая история развития катализа и теорий, объясняющих это явление
Катализ – универсальное и очень разнообразное явление, широко распространенное в природе и используемое человечеством за тысячи лет до осознания сути каталитических процессов. Наилучшим примером служит ферментативный катализ. Люди используют биологические катализаторы – ферменты - тысячи лет в процессах брожения (для приготовления, например, молочно-кислых продуктов).
Что же такое катализ
и катализатор?
В литературе встречаются различные определения катализа и катализатора. Приведем некоторые из них.
В. Оствальд: Катализатор – это такое соединение, которое ускоряет химическую реакцию, не влияя на положение равновесия.
П. Сабатье: Катализатор – вещество или система, которая изменяет скорость реакции, участвуя в последовательности стадий, но не превращаясь в продукты.
Г.К. Боресков: Феноменологически катализ – это возбуждение химических реакций или изменение их скорости под влиянием веществ – катализаторов, многократно вступающих в промежуточное химическое взаимодействие с участниками реакции и восстанавливающих после каждого цикла промежуточных взаимодействий свой состав.
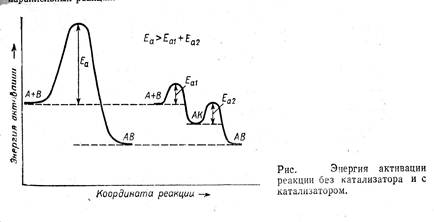
Последнее определение включает два существенных момента: катализатор входит в состав промежуточных соединений, но не фигурирует в стехиометрическом уравнении основной реакции и, следовательно, не влияет на равновесие основной реакции и не расходуется в ней. Катализатор за счет участия в образовании интермедиатов обеспечивает протекание реакции по другому пути, имеющему более низкую наблюдаемую энергию активации, и значит более высокую скорость превращения реагентов в продукты (см. рис. 1).
Химический (небиологический) катализ принято делить на гомогенный и гетерогенный. Гомогенный катализ – это такой процесс, протекающий в одной фазе, в которой находятся реагенты и катализатор. Гетерогенный катализ – это процесс, в котором катализатор – твердое вещество, а реагенты могут быть жидкими или газообразными. С участием гомогенных катализаторов протекают гомогенно-каталитические процессы, а с участием гетерогенных – гетерогенно-каталитические. Эту классификацию нельзя путать с классификацией реакционных систем по фазности (гомофазные – одна фаза, гетерофазные – несколько фаз и есть границы раздела фаз). Системы, в которых протекают гомогенно-каталитические процессы могут быть как гомофазными, так и гетерофазными.
Слово «катализ», вероятно, впервые введено в 16 веке химиком А. Либавиусом в его учебнике «Алхимия» и имело значение «разложение» или «разрушение». В 1835 г. этот термин узаконен И. Берцелиусом для реакций, протекающих в присутствии посторонних соединений, которые сами как будто в реакции не участвуют. Точнее Берцелиус писал о каталитической силе, приводящей к разложению тел. Примерно в то же время Митчерлих ввел термин «контактное действие».
На самом деле даже “небиологический”, т.е. неферментативный катализ был известен задолго до Либавиуса и тем более Берцелиуса.
Первый известный нам пример небиологического каталитического процесса – синтез диэтилового эфира из спирта при участии серной кислоты (VIII в., Джабир ибн Хайам).
C2H5OH + HO-C2H5 → H2O + C2H5-O-C2H5
Вторично эта реакция была открыта в 1540 г. Валерием Кордусом и получила технологическое оформление в работах С. Фробениуса.
В XVII и XVIII вв. во время создания научных основ химии было открыто несколько каталитических реакций с участием небиологических катализаторов. Так, в 1666 г. А. Лефебр и Н. Лемери разработали камерный способ синтеза серной кислоты базируясь на предыдущих разработках. Это XVII век. И только в конце следующего, XVIII века, механизм синтеза серной кислоты изучен М. Клеманом и Х. Дезормом. Они доказали, что в реакции участвуют не только реагенты (SO2 и O2 ), но и оксиды азота:
NO2 + SO2 + H2O → NO + H2SO4
NO + 1/2O2 → NO2
Клеман и Дезорм указали, что оксиды азота – “только орудие для полного окисления серной кислоты”, и отметили два важных принципа катализа: нестехиометричность и цикличность действия оксидов азота.
Механизм вышеупомянутой реакции дегидратации этилового спирта в диэтиловый эфир изучал А. Геннель в лаб. М. Фарадея в 1828 г.
Краткая история открытия каталитических реакций представлена в таблице1.
Таблица 1.
Краткая история катализа
|
Год |
Авторы |
Процесс / катализатор |
|
1 |
2 |
3 |
|
Гомогенный катализ | ||
|
1746 |
Дж. Робек |
SO2 + 0,5 O2 → SO3 / NO2 |
|
1782 |
К. Шееле |
RCOOH + R’OH → RCOOR’ + H2O / Минеральн. к-ты |
|
1878 |
А.М. Бутлеров |
m CnH2n → -(CnH2n)-m / H2SO4 |
|
1881 |
М.Г. Кучеров |
С2Н2 + Н2О → СН3СНО / Hg2+ |
|
1928-1929 |
Ю. Ньюленд |
2 С2Н2 → СН2=СНС≡СН / Cu(I) |
|
1938 |
О. Роелен |
CnH2n + СО + Н2 → CnH2n+1СНО / Со2(СО)8 |
|
1939-1945 |
В. Реппе |
С2Н2 + СО + НХ→ СН2=СНСОХ / Ni(CO)4 С2Н4 + СО + НX → СН3СН2СОХ / Ni(0), Co(0) (X – OH, OR, NR2, SR) 4 С2Н2 → циклооктатетраен / Ni(CN)2 С2Н2 + 2 CH2O → HOCH2C≡CCH2OH / Cu2C2 |
|
1953-1955 |
К. Циглер, Д. Натта |
m α-CnH2n → -(CnH2n)-m / TiCl3-AlR3, TiCl4-AlR3, гомог. и гетерог. катализаторы полим-ции 1-алкенов и диенов |
|
1959 |
Ю. Смидт, И.И. Моисеев |
С2Н4 + 0,5 О2 → СН3СНО / PdCl2-CuCl2 |
|
1960 |
И.И. Моисеев, |
С2Н4 + CH3COOH + 0,5 О2 → СН2=СНОOCCH3 + H2O / PdCl2-CuCl2-CH3COONa |
|
1960 |
Фирма БАСФ АГ |
CH3OH + CO → СН3СОOH / CoI2 |
|
1970 |
Ф.Е. Паулик, Д.Ф. Роз, фирма «Монсанто» |
CH3OH + CO → СН3СОOH / Rh(I)-CH3I |
|
1972 |
Фирма «Халкон» |
Сопряж. процесс получ. стирола и оксида пропилена |
