Теория идеального газа
Содержание
Введение
1. Корпускулярная концепция описания природы
2. Молекулярно-кинетическая теория газа
3. Основные газовые законы для идеальных газов
Заключение
Список литературы
Введение
Еще 200 лет назад законы природы представлялись как разрозненные правила, выведен
ные из опыта и почти не связанные между собой. Многие физики пытались превратить открытые законы, теории, правила, эффекты и явления в строгую науку, но сделать это было не легко. Одни считали, что все явления следует объяснять, опираясь на механику, и что все в природе состоит из мельчайших частиц: атомов, монад, корпускул. Другие настаивали на том, что первичным в природе являются жидкости и что Вселенная заполнена всепроникающей субстанцией – эфиром. Тепло также считали одной из жидкостей, и теория теплорода была весьма популярной основой учения о тепле. Истина рождалась в трудной борьбе идей и мнений.
История о том, как человек обнаруживает законы природы, как создается величественное здание современного естествознания, - история поучительная и интересная.
Во Вселенной течением всех тепловых процессов управляет энтропия, которая возрастает с возрастанием Времени, и величина температуры, как и все другие величины, изменяется со временем и координатами.
Как и все науки, физика пребывает в состоянии непрерывного развития. Постоянно обнаруживаются новые эффекты, открываются связи между разными явлениями природы, формулируются законы.
Самое удивительное в нашем мире – это то, что он познаваем. Но понять его можно только изучив истоки физической науки. Это, может быть, важнее, чем досконально изучить сегодняшние идеи, которые в конце концов могут и сами измениться.
Цель данной работы рассмотреть корпускулярную концепцию описания природы. Задачи данной работы рассмотреть:
1. Корпускулярная концепция описания природы;
2. Молекулярно-кинетическая теория газа;
3. Основные газовые законы для идеальных газов.
1. Корпускулярная концепция описания природы
В физике различают понятия микромир и макромир - соответственно как область физических исследований микрочастиц и привычных нам объектов природы, с которыми обычно сталкивается человек.
Представления о строении материи находят свое выражение в борьбе 2 концепций:
· прерывности или дискретности – корпускулярная концепция (неизменность атомов; все явления природы - результат движения частиц образованных из единой материи, все на Земле состоит из корпускул – мини частиц, т.е. прерывность и дискретность материи).
· непрерывности – континуальная концепция (существует 2 вида материи: вещество и поле, различия между которыми фиксируется на уровне явлений микромира, материя состоит из непрерывных волн, т.е. постоянство материи).
Эти две противоположные концепции описания природы пришли к компромиссу в теории корпускулярно-волнового дуализма (свет обладает и свойствами непрерывных электромагнитных волн и свойствами дискретных фотонов).
Частицы неотделимы от создаваемых ими полей и каждое поле вносит свой вклад в структуру частиц, обуславливая их свойства; единство корпускулярных и волновых свойств всех частиц и фотонов. В этом проявляется единство прерывности и непрерывности в структуре материи.[1]
2. Молекулярно-кинетическая теория газа
Макромир описывают 3 концепции:
1. Механическое движение системы описывается классической механикой Ньютона.
2. Внутреннее строение системы и её свойства описывает МКТ.
3. Процессы превращения энергии в системе описываются классической термодинамикой.
Основные положения молекулярно-кинетической концепции.
1. Атомы и молекулы находятся в непрерывном хаотическом тепловом движении. Интенсивность движения зависит от температуры, поэтому температура – хаотичности системы.
2. Между частицами существуют силы взаимодействия – притяжения и отталкивания. Природа этих сил – электромагнетизм.
3. В отличие от механического движения, нагревание и охлаждение систем может привести к изменению их физических свойств (фазовые переходы – жидкость, газ, твердое тело и т.п.). Фаза – это часть системы, имеющая границу и сохраняющаяся внутри основного физического свойства системы (Давлении, температуре, объеме).
Все эти положения экспериментально доказаны. Подтверждаются явлениями диффузии, броуновского движения и т.д. Количественное подтверждение этой концепции – газовые законы для идеальных газов.[2]
Идеальный газ
1. Расстояние между молекулами во много раз превышает размеры самих молекул, причем, размеры молекул применяются за материальную точку.
2. Между молекулами нет сил межмолекулярного взаимодействия.
Идеального газа не существует, но можно приблизиться к идеальному газу – при низком давлении и высокой температуре молекулы движутся, практически не задевая друг друга. Вещество звезд, находящихся на главной последовательности диаграммы Герцшпрунга-Рессела, на определенной глубине находится в состоянии, очень близком к идеальному газу, несмотря на высокую плотность.[3]
Основное уравнение молекулярно-кинетической теории для идеального газа:
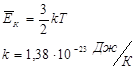
k – постоянная Больцмана.
Этот закон записан для одного моля газа.
![]() - для n-ного количества молей. Если газ одноатомный.
- для n-ного количества молей. Если газ одноатомный.
Данный атом имеет три степени свободы (3 координаты, так как вращение вокруг собственной оси не учитывается. i=3
Если газ двухатомный, то i=5 (поступательное).
Если газ многоатомный, но молекула линейная, то степеней свободы будет 5, если многоатомный, но нелинейный, то 6. Все степени свободны являются равноправными и вносят одинаковый вклад в среднюю кинетическую энергию.
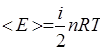
3.Основные газовые законы для идеальных газов
В XVII веке был сформулирован закон Бойля-Мариотта, выражающий зависимость давления(P) от объема (V) при постоянной температуре (Т). (Изотермический).
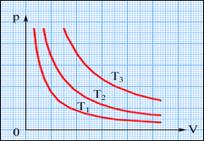
PV=const
XVIII век, Шарль, закон для изохорного процесса,
V=const. ![]()
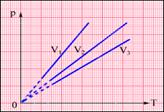
XIX век, Гей-Люссак, изобарный процесс,
P=const. ![]()
На практике же чаще всего все три параметра меняются одновременно.
Клапейрон вывел следующий закон:
![]()
Менделеев показал, что константой в данном случае будет универсальная газовая постоянная R=8,31 ![]()
Другие рефераты на тему «Физика и энергетика»:
Поиск рефератов
Последние рефераты раздела
- Автоматизированные поверочные установки для расходомеров и счетчиков жидкостей
- Энергосберегающая технология применения уранина в котельных
- Проливная установка заводской метрологической лаборатории
- Источники радиации
- Исследование особенностей граничного трения ротационным вискозиметром
- Исследование вольт-фарадных характеристик многослойных структур на кремниевой подложке
- Емкость резкого p-n перехода
