Методы анализа лекарственных препаратов
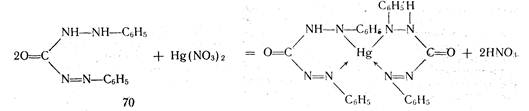
При определении йодидов в процессе титрования образуется бесцветное комплексное соединение 4КI + Hg(NO3)2= К2[НgI4] + 2КNO3.
Точку эквивалентности определяют по образованию неисчезающего красного осадка дийодида ртути (II) К2[HgI4] + Нg(NO3)2 = 2HgI2 + 2КNО3.
Иодиды можно титровать с индикатором дифенилкарбазидом, е
сли в титруемый раствор добавить несколько миллилитров этанола. Красный осадок дийодида ртути (II) растворяется в этаноле, и тогда точку эквивалентности определяют с индикатором по появлению сине-фиолетового окрашивания. Титрование выполняется в кислой среде.
При работе с солями ртути (II) необходимо соблюдать осторожность, помнить, что растворимые соли ртути ядовиты.
К комплексиметрическому титрованию относится куприметрическое определение левомицетина. К раствору левомицетина добавляют несколько капель раствора гидроксида натрия, мурексид (как индикатор) и медленно приливают титрованный раствор сульфата меди до изменения окраски раствора из фиолетовой в коричнево-красную, сравнивая ее с окраской контрольного раствора.
При добавлении гидроксида натрия к раствору левомицетина происходит взаимодействие
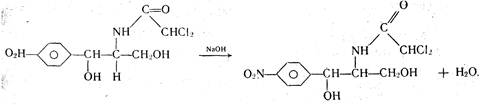
В процессе титрования образуется комплексное соединение:
Комплексонометрический метод основан на реакции образования прочных комплексов полиаминокарбоновых кислот с ионами металлов (Са2+, Mg2+,Zn2+, Вi2+ и др.). Наиболее широко применяется динатриевая соль этилендиаминтетрауксусной кислоты (трилон Б). Трилон Б наряду с карбоксильными группами содержит аминный азот. Вследствие такого строения он является кислотой и комплексообразующим веществом. Многие металлы заменяют атомы водорода карбоксильных групп, одновременно связываясь координационно с азотом аминогруппы и образуя прочные комплексы трилона Б с металлом. Двухзарядный катион (например, Са2+) образует комплексное соединение следующего состава:
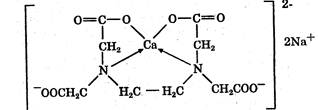
Образование комплексов можно представить схематично:
Na2H2I → 2Na+ + H2I2-
Ме2+ + H2I2- → MeI2- + 2Н+
где Na2H2I — трилон Б; Ме2+ — ион металла. Как видно из приведенной схемы, реакция образования комплексов сопровождается накоплением протонов в растворе, поэтому связывание Н+- ионов должно способствовать образованию комплекса. Наиболее благоприятный для комплексообразования реакцией среды является рН 8—10. Поэтому титрование солей металлов трилоном Б проводят в присутствии аммиачного буфера. Для установления точки эквивалентности применяются специальные индикаторы, которые являются органическими красителями. К ним относятся кислотный хром темно-синий, кислотный хром черный специальный, называемый эриохром черный Т, мурексид, калькон-карбоновая кислота и др. Процесс комплексонометрического титрования заключается в том, что к исследуемому раствору, содержащему определяемый катион, при строго определенном значении рН прибавляют индикатор, при этом образуется хорошо растворимое в воде окрашенное комплексное соединение индикатора с ионом определяемого металла. При титровании трилоном Б этот комплекс разрушается и образуется более прочный, как правило бесцветный, комплекс иона металла с трилоном Б. При этом выделяется анион индикатора, который окрашивает раствор в цвет, присущий свободному индикатору при данном значении рН:
Са2+ + Н2Ind- → CaInd- + 2Н+
CaInd- + H2I2- → CaI2- + H2Ind-
Комплексонометрическое титрование осуществляется как методом прямого, так и методом обратного титрования. Оно позволяет определять количественное содержание солей, оксидов металлов магния, кальция, цинка, свинца, висмута, ртути и др. Метод пригоден также для раздельного определения солей металлов в смеси. Раздельное определение солей кальция и магния при их совместном присутствии основано на том, что растворимость соединений титруемых солей зависит от величины рН в анализируемом растворе. Аликвотную часть раствора титруют вначале с индикатором эриохром черным при рН = 9 в присутствии аммиачного буферного раствора, причем титруются обе соли. В другой аликвотной части определяют соль кальция. В раствор добавляют несколько миллилитров 20%-ного раствора гидроксида натрия, рН этого раствора изменяется от 9 до 12. В этих условиях соли магния осаждаются в виде гидроксида магния, и далее титруют соль кальция с индикатором мурексидом.
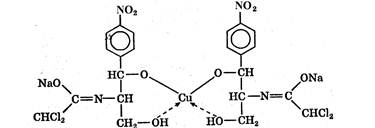
Интерес представляет косвенное комплексонометрическое определение аминопроизводных и солей органических оснований (гидрохлорида папаверина, прозерина, спазмолитина, производных фенотиазина). В этом случае используется раствор тетрароданоцинкат (П)-аммония (ТРЦ), который получают при взаимодействии тиоцианата аммония и сульфата цинка:
Для приготовления 0,5 М раствора ТРЦ берут 144 г сульфата цинка, помещают в мерную колбу вместимостью 1 л, добавляют 152 г тиоцианата аммония, растворяют в воде и доводят водой до 1 л. Тщательно перемешивают, фильтруют через вату, хранят при комнатной температуре. При хранении реактива может выпасть осадок или измениться цвет. Несмотря на эти изменения, реактив годен к применению.
4NH4SCN + ZnSO4 → (NH4)2[Zn(SCN)4] + (NH4)2SO4
При добавлении реактива ТРЦ к анализируемому раствору образуется осадок комплексной соли. Например, при определении прозерина происходит осаждение его в соответствии с уравнением реакции
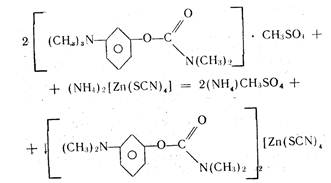
Осадок экстрагируют точно измеренным объемом хлороформа при энергичном взбалтывании в течение 2 мин и фильтруют через бумажный фильтр в сухую колбу. В колбу для титрования отбирают пипеткой определенный объем фильтрата, приливают избыток титрованного раствора трилона Б. Часть титранта вступает во взаимодействие с цинком, образуя прочное комплексное соединение. Не вошедший в реакцию титрант в присутствии аммиачного буферного раствора и индикатора хром темно-синего оттитровывают раствором сульфата цинка.
Окислительно-восстановительное титрование основано на окислительных или восстановительных свойствах анализируемых веществ и титрантов. В процессе титрования происходит изменение окислительно-восстановительных потенциалов взаимодействующих систем. Если разность этих потенциалов достаточно большая, то окислительно-восстановительный процесс протекает практически до конца, и поэтому возможно прямое титрование.
В фармацевтическом анализе применяют такие методы окислительно-восстановительного титрования, как перманганатометрия, йодометрия, йодхлорометрия, йодатометрия, броматометрия, дихроматометрия, цериметрия.
ПЕРМАНГАНАТОМЕТРИЯ основана на использовании окислительных свойств титранта — перманганата калия в кислой и щелочной средах.
МnО4- + 8Н+ + 5е → Мn2+ + 4Н20.
В кислой среде продуктом восстановления являются практически бесцветные соли марганца (II). Поэтому при прямом перманганатометрическом титровании индикатор в анализируемый раствор не добавляют, им является титрант, избыток которого придает раствору розовое окрашивание.
Другие рефераты на тему «Медицина»:
Поиск рефератов
Последние рефераты раздела
- Особенности лечения и тракционно-экстензионной терапии на аппарате Kinetrac KNX-7000
- Остеохондроз, методики лечения
- Тракционно-экстензионная терапия у больных остеохондрозом пояснично-крестцового отдела позвоночника
- Болезни, возникающие от курения. Профилактика курения
- Болезни органов дыхания
- Болезни желчевыводящих путей и печени
- Анатомия и физиология артерий нижних конечностей. Этиология и патогенез
