Структура и состав биологических мембран
Для разрушения клеток, имеющих стенку, требуются более жесткие методы. Иногда перед разрушением клеток их сначала обрабатывают ферментами, расщепляющими компоненты клеточной стенки, чтобы облегчить ее последующее разрушение. Так, например, для разрушения клеток Е. coli используют обработку буфером трис-ЭДТА и лизоцимом. Более жесткие приемы предусматривают растирание клеток, обработку их ультра
звуком и экструзию. Растирание обычно проводят в присутствии различных абразивных материалов - песка, окиси алюминия или стеклянных шариков. Малые объемы материала можно растирать в ступке с помощью пестика, но для больших объемов следует использовать специальные механические приспособления. Бактериальные клетки часто разрушают с помощью ультразвука. Полагают, что в этом случае разрушение происходит под действием сдвиговых усилий, возникающих в результате кавитации. Такие же усилия возникают при продавливании суспензии клеток через небольшое отверстие, например при разрушении клеток с помощью пресса Френча. Существует много разновидностей перечисленных методов, и их выбор зависит от особенностей той мембранной системы, которая подлежит изучению.
Следует отметить, что получаемые при разрушении клеток мембранные фрагменты обычно спонтанно образуют везикулы. В качестве примера можно привести:
1) микросомы, получаемые из плазматической мембраны, эндоплазматического ретикулума или специализированных систем, таких, как саркоплазматическая мембрана;
2) субмитохондриальные частицы из внутренней митохондриальной мембраны;
3) синаптосомы, образующиеся при отрыве нервных окончаний в области синаптических контактов;
4) бактериальные мембранные везикулы, образующиеся из плазматической мембраны Е. coli. Везикулы образуются и из других мембранных систем, например из мембран аппарата Гольджи. Их размер в большинстве случаев сильно зависит от метода разрушения клеток. Это особенно важно, поскольку размеры везикул в значительной степени определяют скорость их седиментации при центрифугировании и их поведение на следующих стадиях очистки мембран. Некоторые мембраны не образуют везикул, в частности мембраны боковых поверхностей соприкасающихся друг с другом животных клеток. При разрушении таких клеток происходит отрыв пары смежных мембранных фрагментов, удерживаемых вместе областью контакта. Наличие таких контактов предотвращает замыкание фрагментов в везикулы, поэтому мембраны выделяются в виде пластин или лентообразных структур.
Большое значение при разрушении клеток имеет также правильный выбор среды. Например, чтобы сохранить замкнутость мембранных органелл, следует использовать такую среду, которая изоосмотична их внутреннему содержимому. Чаще всего для этого используют раствор сахарозы в концентрации 0,25-0,30 М. В ряде случаев лучше использовать сорбитол и маннитол. Следует отметить, что сохранение изотоничности играет важную роль и на последующих стадиях препаративного выделения интактных органелл.
4.2 Разделение мембран
В настоящее время для разделения мембран чаще всего применяют центрифугирование. Мембранные частицы можно разделить по скорости их седиментации или по плавучей плотности. Первый метод называется зональным центрифугированием, и разделение происходит в соответствии со значениями S, а второй - изопикническим центрифугированием, и разделение происходит в условиях равновесной плотности. На практике обычно применяют некий гибрид этих двух методов. На рис.1.7 показано положение некоторых субклеточных единиц на координантной плоскости "S-g".
По оси абсцисс отложены коэффициенты седиментации частиц, а по оси ординат - плотность.
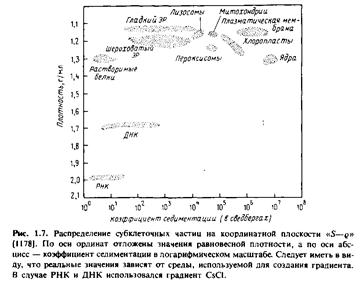
Принцип разделения по скорости седиментации можно легко уяснить, сравнив значения S для разных фракций. Например, ядра имеют относительно высокие значения S, т.е. скорость их седиментации значительно выше, чем у большинства других субклеточных органелл. Ядра можно избирательно осадить центрифугированием клеточного гомогената, при этом все другие органеллы останутся в надосадочной жидкости. В то же время гладкий и шероховатый эндоплазматический ретикулум не удается разделить с помощью зонального центрифугирования.
Для выделения различных мембранных фракций из клеточного гомогената часто используют различия в их плотности. С этой целью проводят центрифугирование в градиенте плотности. Чаще всего для создания градиента плотности используют сахарозу, однако этот метод имеет серьезные недостатки. Чтобы получить плотность, требуемую для разделения различных мембранных фракций, необходимо готовить растворы с высокой концентрацией сахарозы, которые обладают высокой вязкостью и к тому же являются гипертоничными. Внесение субклеточных органелл в гипертоничный раствор сахарозы приводит к их дегидратации, а последующее доведение раствора до изотонических условий часто сопровождается лизисом и повреждением органелл. Другая проблема состоит в том, что многие мембранные органеллы проницаемы для сахарозы. Это также может привести к осмотическому разрушению органелл. Проникновение сахарозы в разделяемые мембранные органеллы может изменить их эффективную плотность.
Таблица 1.1. Физические время все чаще используют другие среды для создания градиента плотности. Некоторые из этих сред перечислены в табл.1.1
|
Концентрация, |
Плотность, |
Вязкость, |
Осмоляльность, | |
|
% (в/о) |
г/мл |
сП |
мОсм/кг НгО | |
|
Сахароза |
20 |
1,06 |
30 |
700 |
|
Метризамид |
30 |
1,16 |
2 |
260 |
Чтобы решить эти проблемы, в последнее свойства градиентных сред.
1. Фиколл. Высокомолекулярный гидрофильный полимер сахарозы, который можно использовать для получения растворов С'Плотностью вплоть до 1,2 г/мл. Основное его преимущество состоит в низком осмотическом давлении растворов по сравнению с растворами с эквивалентной концентрацией сахарозы. Благодаря этому можно создавать растворы, изотоничные во всем диапазоне концентраций благодаря дополнительному включению в среду сахарозы или приемлемых с физиологической точки зрения солей. Недостатками являются высокая вязкость получаемых растворов и существенно нелинейная зависимость вязкости и осмолярности от концентрации.
2. Метризамид. Трииодзамещенный бензамид глюкозы Растворы метризамида имеют большую плотность, чем расторы фиколла при тех же концентрациях. Основным преимуществом растворов метризамида является их очень низкая вязкость, что позволяет ускорить разделение.35% -ный раствор метризамида имеет почти физиологическую осмолярность, так что большую часть операций в ходе разделения мембран можно проводить, не подвергая их действию гипертоничных растворов. Метризоат натрия - родственное метризамиду соединение с близкими свойствами, с тем лишь отличием, что его раствор является изотоничным при концентрации около 20%. Метризоат натрия ис- пользуют прежде всего для выделения интактных клеток. Найкоденз также является производным трииодбензойной кислоты, но имеет три гидрофильные боковые цепи. При центрифугировании он быстро образует свой собственный градиент плотности; используется для выделения субклеточных органелл.
Другие рефераты на тему «Биология и естествознание»:
Поиск рефератов
Последние рефераты раздела
- Влияние экологических факторов на разнообразие моллюсков разнотипных искусственных и естественных водоемов
- Влияние экологии водоемов на биологическое разнообразие фауны
- Влияние фтора и фторосодержащих соединений на здоровье населения
- Влияние факторов внешней среды на микроорганизмы
- Влияние физической нагрузки на уровень адренокортикотропного гормона, адреналина, кортизола, кортикостерона в сыворотке крови спортсменов
- Временные аспекты морфогенетических процессов. Эволюция путем гетерохронии
- Вопросы биоэтики
