Структура и состав биологических мембран
Некоторую информацию о расположении мембранных белков дали новые методы, ставшие теперь уже "классическими", - методы замораживания-скалывания и замораживания-травления. В этих случаях препараты быстро замораживают, не подвергая их при этом каким-либо повреждающим воздействиям, как при получении тонких срезов. Процесс подготовки препарата включает следующие операции.
После замораж
ивания образец, представляющий собой суспензию клеток или мембран, скалывают с помощью ножа при низкой температуре в глубоком вакууме. Возникающие при скалывании усилия приводят к образованию среза, проходящего через образец. Оказалось, что, когда плоскость среза проходит через мембрану, последняя раскалывается преимущественно по своей срединной области и расщепляется на две половинки. В результате на образовавшихся плоскостях скола обнажается внутренняя область мембраны.
При необходимости образец подвергают травлению - проводят обычную возгонку льда в вакууме. Это позволяет лучше визуализировать поверхностные структуры клеточных мембран.
После этого получают так называемую реплику с обнаженной поверхности. Именно эту реплику и изучают под электронным микроскопом. Для получения реплики сначала напыляют на образец платину под углом около 45°, чтобы выявить топологические характеристики препарата. Затем платиновой реплике придают механическую прочность, нанеся на нее слой углерода. После этого препарат оттаивают, реплика всплывает, и ее вылавливают с помощью специальной сеточки.
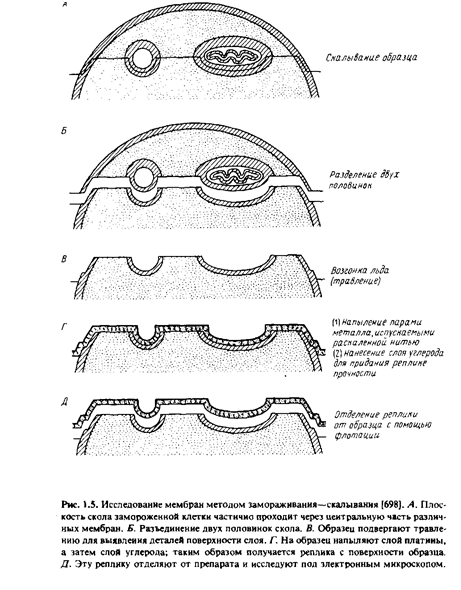
Наиболее характерные структуры, наблюдаемые при изучении мембран методом замораживания-скалывания, - это многочисленные внутримембранные частицы диаметром от 80 до 100 А, лежащие в плоскости мембранных сколов. Обычно они расположены хаотично, но иногда образуют группы. Многочисленные исследования показали, что эти частицы, возможно, являются мембранными белками. Любопытно, что при электронной микроскопии тонких срезов подобные структуры не обнаруживаются. Реплики, полученные от двух половинок расщепленной мембраны, не всегда бывают топологически комплементарными. Это означает, что некоторые частицы связаны только с одной из половин мембраны. Данные, полученные методом замораживания-скалывания, широко использовались Сингером и Николсоном при создании жидкостно-мозаичной модели мембран, поскольку они убедительно показывали, что глобулярные белки находятся не только на поверхности мембраны, но и внутри бислоя.
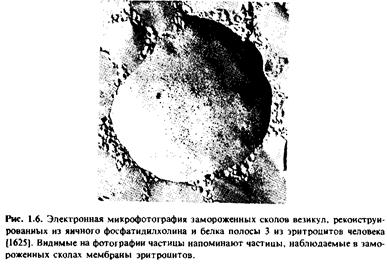
На рис.1.6 приведена электронная микрофотография препарата протеолипосом, реконструированных из яичного фосфатидилхолина и нефракционированного препарата белка полосы 3 из мембраны эритроцитов человека; препарат получен методом замораживания - скалывания.
Белок полосы 3 является основным белковым компонентом мембраны эритроцитов и, как известно, осуществляет перенос анионов. Если фосфолипидные везикулы не содержат этого белка, то полученные препараты замороженных сколов имеют гладкую поверхность.
При встраивании белка полосы 3 в фосфолипидные везикулы на сколах появляются внутримембранные частицы, практически неотличимые от частиц, наблюдаемых в мембранах эритроцитов. Более того, при рН 5,5 частицы, наблюдаемые в мембране эритроцитов, агрегируют, причем эта агрегация осуществляется в результате взаимодействия белка полосы 3 с двумя другими белками, спектрином и актином.
Последние являются компонентами цитоскелета, находящимися на внутренней поверхности эритроцитарной мембраны. Аналогичным образом ведет себя и реконструированная система, состоящая из белка полосы 3 и фосфатидилхолина, при этом агрегация частиц наблюдается в присутствии спектрина и актина при рН 5,5, но не при рН 7,6.
Эти данные еще более упрочили представление о мембранных белках как о глобулярных частицах, свободно перемещающихся в плоскости мембраны. Интересно, что статичные микрофотографии препаратов, полученных методом замораживания-скалывания, помогли исследователям в изучении динамических свойств мембран. Как мы увидим, в мембранах есть много белков, которые не могут свободно плавать в "липидном море".
4. Выделение мембран
В течение последних трех десятилетий становилось все более очевидно, что огромное большинство клеточных функций осуществляется при непосредственном участии мембран.
И растительные, и животные клетки разделены на отсеки, причем многие цитоплазматические органеллы, как было показано в разд.1.1, имеют мембранную природу.
Кроме органелл, характерных для большинства клеток, имеются и специализированные мембранные системы, такие, как саркоплазматический ретикулум мышечных клеток, миелиновая оболочка периферических нервных волокон, тилакоидные мембраны хлоропластов и мембраны дисков в палочках сетчатки. У прокариотических организмов также имеются мембраны, хотя и не настолько развитые, как у эукариотических.
Грамположительные бактерии, например Bacillus subtilis, имеют лишь цитоплазматическую мембрану, а грамотрицательные, такие, как Escherichia coli, - еще и наружную, расположенную поверх тонкой пептидогликановой клеточной стенки.
В клетках прокариот обнаружены также некоторые специализированные органеллы. Некоторые вирусы, патогенные для животных, например вирусы с оболочкой, имеют самую настоящую мембрану, причем такие мембраны оказались чрезвычайно интересными для изучения.
Исследование мембран, как правило, сопряжено с их очисткой, при этом для каждого типа мембран характерны свои условия препаративного выделения.
Так, если предстоит исследовать плазматическую мембрану каких-либо клеток, то сначала необходимо выделить эти клетки из ткани. Затем нужно подобрать оптимальные условия разрушения клеток и отделения мембран, представляющих интерес, от других клеточных компонентов. Особого внимания заслуживают критерии чистоты выделенных мембран.
4.1 Разрушение клеток
Желательно выбирать такую методику, которая позволяет эффективно разрушить сами клетки при сохранении структуры мембран, подлежащих выделению. Для многих животных клеток можно использовать такую относительно мягкую процедуру, как гомогенизация в гомогенизаторах Даунса или Поттера-Элвехейма со стеклянными стенками и тефлоновым пестиком. При этом клетки разрушаются за счет сдвиговых усилий, возникающих при продавливании суспензии через узкий зазор между тефлоновым пестиком и стеклянной стенкой гомогенизатора. При такой обработке "срывается" плазматическая мембрана и разрушаются связи между различными органеллами при сохранении целостности самих органелл. С помощью такой процедуры можно также отделить друг от друга специализированные участки плазматической мембраны, например ба-золатеральную или апикальную области мембраны эпителиальных клеток. Желательно работать в условиях, когда целостность органелл сохраняется, чтобы свести к минимуму возможность высвобождения гидролитических ферментов и облегчить последующие операции по разделению мембран.
Другие рефераты на тему «Биология и естествознание»:
Поиск рефератов
Последние рефераты раздела
- Влияние экологических факторов на разнообразие моллюсков разнотипных искусственных и естественных водоемов
- Влияние экологии водоемов на биологическое разнообразие фауны
- Влияние фтора и фторосодержащих соединений на здоровье населения
- Влияние факторов внешней среды на микроорганизмы
- Влияние физической нагрузки на уровень адренокортикотропного гормона, адреналина, кортизола, кортикостерона в сыворотке крови спортсменов
- Временные аспекты морфогенетических процессов. Эволюция путем гетерохронии
- Вопросы биоэтики
