Фотосинтез как основа энергетики биосферы
Механизм фосфорилирования AДФ, сопряженного с деятельностью ЭТЦ , объясняет хемиосмотическая теория, разработанная английским биохимиком П. Митчеллом (1961 — 1966). Для объяснения процессов фотофосфорилирования эта теория была впервые использована А. Ягендорфом (1967).
Сущность хемиосмотическ
ой теории состоит в следующем. Цепь переносчиков электронов и прогонов, действующая в соответствии с окислительно-восстановительным градиентом, перешнуровывает мембрану таким образом, что трансмембранный перенос е- и Н+ в одну сторону чередуется с переносом в обратную сторону только е-. В результате функционирования такого механизма (Н + -помпы) по одну сторону мембраны накапливается избыток Н+ и возникает электрохимический (т. е. электрический и концентрационный) потенциал ионов Н+, который служит формой запасания энергии. Обратный пассивный ток ионов Н+ через протонный канал Н+-АТФазы, получивший название сопрягающего фактор CF1, сопровождается образованием высокоэнергетической фосфатной связи АТФ.
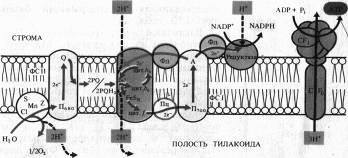
На рис. 6.1 представлена упрощенная схема расположения переносчиков в мембране тилакоидов, объясняющая механизм фотофосфорилирования. На внутренней стороне мембраны тилакоида под действием света возбуждаются П680 и П700. Электроны от П680 захватываются акцепторами е- на наружной стороне и передаются на окисленную форму пластохинона (PQ) — липидорастворимого переносчика прогонов и электронов, выполняющего функцию челнока. Принимая два электрона, 2PQ диффундируют к цитохромному комплексу и захватывают из стромы 2Н + . Электроны с 2PQH2 поступают в цепь: F.eSR -> цит. f -> Пц,-> П700, а ионы Н + попадают в полость тилакоида. Вторая пара ионов Н+ освобождается там же при фотоокислении воды. В ФС I электроны П700 захватываются акцептором А, передаются ферредоксину и затем НAДФ+ на наружной стороне мембраны, причем 1Н+ используется на восстановление НAДФ.
Таким образом, из среды, окружающей тилакоид, при поглощении пигментами квантов света исчезают, а во внутренней полости тилакоида появляются протоны. В результате на мембране возникает электрохимический потенциал ионов Н + , который затем используется для фосфорилирования AДФ. Этот процесс называется нециклическим фотофосфорилированием.
При циклическом фотофосфорилировании, когда функционирует только ФС I, электроны от Фд поступают на цитохромный комплекс с использованием пула PQ, который действует как переносчик электронов и протонов. Затем электроны через цитохром f и Пц возвращаются на основной энергетический уровень в П700, а протоны поступают в полость тилакоида.
Белковые комплексы, участвующие в фотохимических реакциях фотосинтеза, в мембранах хлоропластов распределены неравномерно. Наибольшие различия наблюдаются между теми мембранами, которые плотно состыкованы друг с другом в гранах и теми участками мембран, которые контактируют со стромой (закругленные участки тилакоидов гран и мембраны тилакоидов стромы).
Светособирающий комплекс и пигмент-белковый комплекс ФС II находятся в основном в мембранах, плотно контактирующих друг с другом, причем ССК играет особую роль. В адгезии тилакоидных мембран.
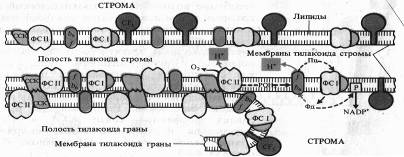
Показано, что у мутанта хламидомонады, лишенного белка, с которым связан хлорофилл Ь, граны не образуются. ФС I со своим светособирающим комплексом преимущественно, а АТФазный комплекс (CF1 + CF0), как правило, находятся на несостыкованных участках мембран. Комплекс цитохромов b6 — f равномерно распределен как в состыкованных, так и в не состыкованных мембранах. Такое распределение белковых комплексов, участвующих в световой фазе фотосинтеза, ставит вопрос о способе их взаимодействия. Показано, что это взаимодействие осуществляется с помощью легкоподвижного липофильного пластохинона PQв липидной фазе и благодаря перемещению водорастворимого пластоцианина вдоль внутренних поверхностей ламелл и водорастворимого ферредоксина вдоль ихнаружных поверхностей.
К латеральным перемещениям вдоль мембраны способны и сами белковые комплексы. На это передвижение влияет величина их электрического заряда. Например, восстановление пластохинона PQфотосистемой II приводит к активации киназы и фосфорилированию ССКа-ь. Фосфорилирование ССК увеличивает его отрицательный заряд, что способствует перемещению ССК в стромальную область мембраны и возрастанию миграции поглощенной энергии света к ФС I. Возросшая фотохимическая активность ФС I усиливает окисление PQ,что, в свою очередь, приводит к инактивации киназы, фосфатаза же дефосфорилирует ССК. Таким образом, обратимое фосфорилирование ССК представляет собой петлю обратной связи в системе взаимной регуляции активности ФС I и ФС II. Механизм такой регуляции включает латеральный транспорт белковых комплексов в мембранах хлоропластов.
6 Метаболизм углерода при фотосинтезе (темновая фаза)
В результате фотохимических реакций в хлоропластах создается необходимый уровень АТР и NADPH. Эти конечные продукты световой фазы фотосинтеза стоят на входе в темновую фазу, где С02 восстанавливается до углевода:
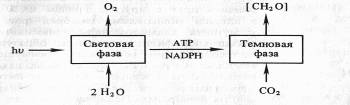
Однако сами по себе АТФ и НAДФH не в состоянии восстановить С02. Очевидно, и темновая фаза фотосинтеза — сложный процесс, включающий большое количество реакций. Кроме того, существуют различные пути восстановления С02. В настоящее время известны так называемые С3-путь и С4-путь фиксации С02, фотосинтез по типу толстянковых (САМ-метаболизм) и фотодыхание. Рассмотрим каждый из этих путей в отдельности.
6.1 Химизм реакции цикла Кальвина
Этот способ ассимиляции С02, присущий всем растениям, в 1946—1956 гг. был расшифрован американским биохимиком М. Кальвином и его сотрудниками. Прежде всего, была поставлена задача обнаружить первичный продукт фотосинтеза и выяснить, какое соединение служит акцептором С02.
Для решения первого вопроса были использованы одноклеточные зеленые водоросли (хлорелла и др.) и меченый 14С02. Фотосинтезирующие водоросли помещали в среду, содержащую 14С02, на разные промежутки времени, затем клетки быстро фиксировали, экстрагировали из них спирторастворимые вещества и определяли содержание 14С в различных соединениях после их разделения с помощью хроматографии.
Оказалось, что после экспозиции в течение 1 мин 14С включался в С3 —С7-сахара и фосфосахара, в органические кислоты (яблочную, щавелевоуксусную, ФЕП), в аминокислоты (аланин, аспарагиновую кислоту). Если же время экспозиции было сокращено до 0,1—2 с, то большая часть метки обнаруживалась в фосфоглицериновой кислоте, в ее карбоксильной группе:
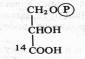
Следовательно, 3-фосфоглицериновая кислота (ФГК) является первичным продуктом фотосинтеза.
Второй вопрос — природа первичного акцептора С02. Сначала предположили, что таким акцептором является какое-либо двухуглеродное соединение. Однако введение в инкубационную среду винилфосфата, фосфогликольальдегида и других веществ с С2 не приводило к увеличению содержания радиоактивной метки из С02 в ФГК. Тогда схему опыта видоизменили следующим образом. Водоросли экспонировали на свету при высокой (1 %-ной) концентрации С02, затем резко снижали его концентрацию до 0,003%. Расчет был на то, что в условиях дефицита С02 быстро накопится именно то соединение, которое служит акцептором С02. С помощью двумерной хроматографии удалось установить, что при отсутствии возможности карбоксилирования в клетках кратковременно возрастает концентрация рибулозо-1,5-дифосфата (рибулозо-1,5-бисфосфата). Отсюда возникло предположение, что первичная фиксация С02 происходит следующим образом : С5 + С02-> С6-► 2С3. Для проверки этой гипотезы в бесклеточный экстракт из листьев шпината или клеток хлореллы вносили меченный по 32Р рибулозо-1,5-дифосфат. На свету в экстракте появлялась радиоактивная ФГК.
Другие рефераты на тему «Биология и естествознание»:
Поиск рефератов
Последние рефераты раздела
- Влияние экологических факторов на разнообразие моллюсков разнотипных искусственных и естественных водоемов
- Влияние экологии водоемов на биологическое разнообразие фауны
- Влияние фтора и фторосодержащих соединений на здоровье населения
- Влияние факторов внешней среды на микроорганизмы
- Влияние физической нагрузки на уровень адренокортикотропного гормона, адреналина, кортизола, кортикостерона в сыворотке крови спортсменов
- Временные аспекты морфогенетических процессов. Эволюция путем гетерохронии
- Вопросы биоэтики
