Химия гидразина
R2N—NHCHR’2→ R2N-N = CR’2
Тетразамещенным гидразинам 4 уделяется по сравнению с другими классами меньше внимания. Тетрафенилгндразин, однако, интересен проявлением особых свойств из-за перекрывания объемистых фенильных групп, окружающих маленькие атомы азота. Даже при температуре жидкого воздуха тетрафенилгидразин разлагается в присутствии кислоты с образованием ионов и, возможно, ра
дикалов. Очевидно, в этом соединении связь азот — азот ослаблена вследствие стерического перекрывания, так как другие тетразамещенные гидразины совершенно устойчивы по отношению к кислотам:
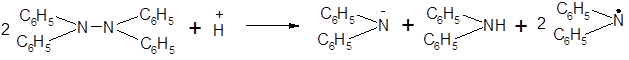 |
Для сочетания двух атомов азота с образованием 1,1-бис-азиридина был использован циклический хлорамин, полученный из этиленимина, что иллюстрирует возможный путь синтеза других тетразамещенных гидразинов:
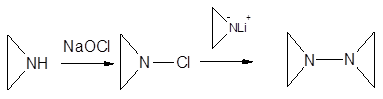 |
Получившийся в ходе этой реакции гидразин — слабое основание и разлагается при нагревании в присутствии кислорода со взрывом.
ГИДРАЗИНИЕВЫЕ СОЛИ
Раствор гидразина в воде обладает основными свойствами. Электрометрическое титрование такого раствора показывает, что гидразин является слабым основанием и ведет себя практически как монокислотное основание.
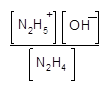 Были вычислены константы ионизации гидразина при 25°С, которые имеют следующие значения:
Были вычислены константы ионизации гидразина при 25°С, которые имеют следующие значения:
K1 = = 8.5*10-7
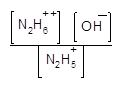 |
K2= = 8.9*10-16
Величина второй константы ионизации настолько мала, что двузамещенные соли гидразина в водном растворе не существуют. Ионы N2H6+ + полностью реагируют с водой (растворителем) в соответствии с уравнением:
![]()
Поскольку гидразин практически является монокислотным основанием, он напоминает скорее аммиак и амины, чем органические диамины. Однако гидразин является значительно более слабым основанием, чем аммиак, что можно видеть при сопоставлении соответствующих констант ионизации, а также теплот нейтрализации этих оснований кислотами в водном растворе.
Гидразин образует не только одно- и двухосновные соли типа N2Н4-2НА, где НА представляет собой обычную одноосновную кислоту, но дает также соединения типа (N2Н4)2·Н2В, N2Н4-Н2В и N2Н4-2Н2В. где Н2В — двухосновная кислота. Известны также различные двойные соли, наиболее важными из которых являются двойные сульфаты и двойные хлориды. Кроме того, были исследованы двойные бромиды, иодиды, цианиды ,тиосульфаты , сульфиты , селенаты , нитраты и ферронианиды. Эти двойные соли в основном были получены взаимодействием в водном растворе соответствующих солей металлов и гидразина, взятых в требуемых молярных соотношениях.
Ранее для приготовления простых солей гидразина приходилось применять различные сложные методы. Однако после того как стал доступен водный раствор гидразина, соли легко и быстро можно получать простой нейтрализацией его соответствующими кислотами. В некоторых специальных случаях для этой цели могут быть использованы также реакции двойного разложения с применением сульфата гидразина и соответствующих бариевых солей.
ОБЩИЕ СВОЙСТВА СОЛЕЙ ГИДРАЗИНА
Соли гидразина, содержащие одну молекулу двухосновной кислоты, устойчивы в водных растворах. Однако двухкислотные соли существуют только в твердом состоянии и при растворении в воде немедленно гидролизуются. Так, например, раствор дигидрохлорида гидразина не отличается от раствора, содержащего эквимолекулярные количества свободной хлористоводородной кислоты и моногидрохлорида гидразина.
ы2н4.нх^ад++х-,
Ы2Н4-2НХ+Н20 — ад++2Х-+Н(Н20) + .
Однокислотные соли 1Ч2Н4-НА обычно более устойчивы в водном растворе, чем двухкислотные соединения 1Ч2Н4-2НА. Последние легко могут быть получены кристаллизацией из водных растворов, содержащих избыток кислоты. Поскольку соли гидразина являются аналогами соответствующих солей аммония, то нет ничего неожиданного в том, что большинство из них очень хорошо растворимо в воде и довольно плохо растворимо в неполярных органических растворителях.
Нагревание солей гидразина в большинстве случаев приводит к их разложению; лишь очень немногие из них устойчивы при температурах плавления. Двухкислотные соли при нагревании обычно разлагаются с образованием в качестве промежуточных продуктов однокислотных солей:
К2Н4-2НаД- К2Н4-НА+НА.
Моноалкилгидразины атакуются простейшими галогеналкилами по замещенному атому азота, если не возникает пространственных препятствий. Когда гидразин реагирует с избытком простого галогеналкила (например, йодистого метила), получается 1, 1, 1-тризамещенный гидразин — гидразиниевая соль. Большие алкильные группы, такие как изопропил, не могут размещаться по три у одного атома азота и обычно образуют смеси моно-, 1,1- и 1,2-дизамещенных гидразинов. Лучшим способом получения гидразиниевых солей, допускающим большее разнообразие заместителей, является обработка третичного амина хлорамином:
R3N + NH2C1 → R3N+—NH2Cl-
Обычные электронодонорные свойства алкильных групп привели некоторых исследователей к предсказанию более высокой основности (и, следовательно, более низкой кислотности протонированной формы) замещенных гидразинов по сравнению с самим гидразином.
Однако, вопреки ожиданию, метилирование гидразина не повышает основности; гидрохлорид гидразина — более слабая кислота (рКа = 7,95; 8,1), чем гидрохлорид метилгидразина (рКа = 7,87), который в свою очередь слабее гидрохлорида диметилгидразина как кислоты (рКа = 7,21). Такую, кажущуюся аномальной, кислотность гидрохлоридов гидразинов можно объяснить следующим образом: в протонированной форме 1,1-диметилгидразина первый атом азота имеет тетраэдрическую конфигурацию, которая вызывает стерическое отталкивание между метильными группами и вторым атомом азота. Потеря протона и, следовательно, потеря тетраэдрической конфигурации способствует уменьшению напряжения в молекуле. Так как напряжение тетраэдрической конфигурации в диметилгидразине больше, чем в метилгидразине, и еще больше, чем в самом гидразине, потеря протона в случае гидрохлорида диметилгидразина энергетически более выгодна, чем в случае гидрохлоридов метилгидразина или незамещенного гидразина. Равновесие смещается, поэтому вправо, и это увеличивает кислотность гидрохлорида диметилгидразина:
![]()
![]() (CH3)2NH-NH2 (CH3)2N-NH2 + Н+
(CH3)2NH-NH2 (CH3)2N-NH2 + Н+
Другие рефераты на тему «Химия»:
- Абсорбционная установка
- Молекулярная подвижность в ненаполненных и наполненных сшитых кремнийорганических каучуках
- Силикагель и его применение в высокоэффективной жидкостной хроматографии
- Водорастворимые полимеры
- Модификация вторичных полимеров для изготовления изделий различного функционального назначения
