Химия гидразина
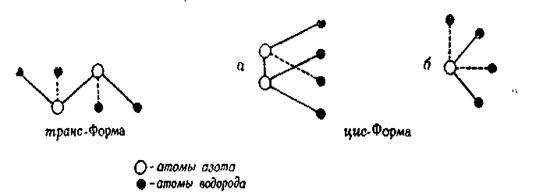
Если связи N—Н расположены в пространстве так, как это указано на рисунке, то очевидно, что цис-форма гидразина должна иметь два стереоизомера. Эти выводы подтверждают предположение, впервые высказанное Пенни и Сазерлендом, которые вычислили, что дипольный момент структуры, соответствующей несимметричной цис-форме, равен 1,70 дебая; они предположили также, что валентные углы N—N—Н и Н—N—Н соста
вляют приблизительно 110°С. Электронографические исследования паров гидразина показывают, что углы Н—N—Н и Н—N—N приблизительно составляют 108±10°С. Межатомные расстояния равны:
rN-H=1,04 ± 0,06Е и rN-N = 1,47 ± 0,02 Е. Эти значения валентных углов и межатомных расстояний очень близки к соответствующим значениям для молекулы аммиака. Возможно также, что гидразин существует в таутомерной аминоимидной форме, Н3N → NН, и что протон при этом способен мигрировать, образуя молекулу с указанной структурой.
|
|
Рис. 1. Структуры гидразина.
а—в перспективе; б— ось N-N перпендикулярна к плоскости рисунка.
Возросший интерес к гидразину и его производным обусловлен отчасти использованием некоторых гидразинов в военной технике [и космических исследованиях] в качестве ракетных топлив, а также разнообразным применением производных гидразина в медицине и сельском хозяйстве.
Гидразин—весьма реакционноспособное соединение: он окисляется на воздухе, окисление протекает через промежуточное образование диимида, давая азот. Как уже отмечалось, превращение гидразина в элементарный азот сопровождается выделением большого количества энергии. Поэтому, а также в результате легкости его получения по методу Рашига гидразин нашел широкое применение в. качестве ракетного топлива. Если использовать его в сочетании с азотной кислотой как окисляющим агентом, то газообразные продукты окисления гидразина (азот, окислы азота) развивают очень эффективную тягу. Некоторыми недостатками гидразина как топлива являются высокая температура плавления, малая стабильность на воздухе и коррозионная активность, затрудняющие хранение и работу с ним.
Из трехфтористого азота при повышенной температуре был получен тетрафторгидразин, но, как и ожидалось, наличие сильно электроотрицательных атомов фтора делает это соединение еще менее стабильным, чем гидразин. Метилгидразин, превосходя гидразин по некоторым физическим показателям, по-видимому, вытеснит последний как жидкое ракетное топливо.
Производные гидразина можно разделить на моно-, ди-, три- и тетразамещенные:
RNH-NH2 RNH-NHR 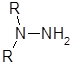

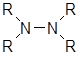
1 2а 2б 3 4
Дизамещенные гидразины 2 следует подразделить на два класса и рассматривать их отдельно, так как первичная аминная функция в 1,1-дизамещенных гидразинах 2б обусловливает свойства, которыми не обладают 1,2-дизамеш.енные гидразины 2а.
Был описан удобный метод аминирования вторичных и третичных аминов до гидразинов и гидразиниевых солей О-гидроксиламинсульфокислотой:
NH 2 O S О3H + R 2 NH —>- R 2 N—NH 2 + H 2S О4
Этот реагент является удобным источником частиц NH2 и может найти в будущем более широкое применение.
Сильно нуклеофильный характер гидразина и алкилгидразинов проявляется в различных реакциях. Так, ряд активированных ароматических галогенпроизводных можно ввести в реакцию с гидразином, в результате образуются арилгидразины:
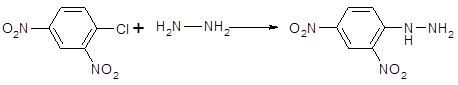
Аналогично гидразин атакует олефины, обедненные электронами, например б,в-ненасыщенные сложные эфиры, с последующей циклизацией в пиразолидоны:
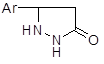 |
![]() ArCH = CHCOOR + H2N—NH2 → ArCHCH2COOR →
ArCH = CHCOOR + H2N—NH2 → ArCHCH2COOR →
NH — NH2
Интересный вариант приведенной выше реакции был найден при взаимодействии 1, 1-диалкилгидразинов и акролеина. Здесь начальная атака более нуклеофильного трехзамещен-пого атома азота с последующей циклизацией приводит к четвертичной пиразолиниевой соли. Мягкое разложение этой соли щелочью разрывает связь N—N, давая в-аминонитрил :
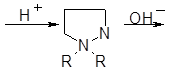 |
R2N – NH2 + CH2=CHCHO R2NCH2CH2CN
Первой стадией этой реакции является образование диметилгидразона, циклизующегося в кислой среде. Последняя стадия представляет собой один из частных случаев аминонитрильной перегруппировки четвертичных альдогидразониевых структур под действием щелочей.
МОНОЗАМЕЩЕННЫЕ ГИДРАЗИНЫ
Монозамещенные гидразины 1 по химическим свойствам подобны незамещенному родоначальнику и также легко окисляются многими окислителями, включая воздух. Другие окислители легко реагируют с монозамещенными гидразинами; так, бром окисляет фенилгидразин до бромбензола и азота. Алкилирование монозамещенных гидразинов дает 1, 1-диалкил- и более замещенные гидразины. Фенилгидразин алкилируется по первому замещенному атому азота (1), хотя многие утверждали, что он метилируется йодистым метилом по второму атому азота, образуя 1-фенил-2-метилгидразин.
Следует отметить, что из возможных переходных состояний при алкилировании замещенного гидразина возникающий положительный заряд будет больше стабилизирован при замещенном атоме азота; промежуточное соединение уравнения (1) стабилизировано индуктивным эффектом ароматического кольца, что невозможно в альтернативном 1,2-ди-замещенном промежуточном соединении:
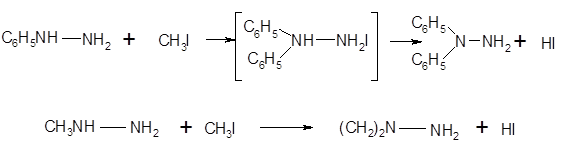 |
(1)
(2)
Монозамещенные гидразины реагируют с различными карбонильными соединениями. В реакции с альдегидами или кетонами продуктами будут гидразоны и вода. С карбоновыми кислотами, хлорангидридами или сложными эфирами образуются 1-замещенные гидразиды .
Из многих гидразинов типа 1 фенилгидразин нашел применение в химии углеводов (например, образование озазонов), а 2,4-динитрофенилгидразин широко используется при идентификации альдегидов и кетонов в виде твердых динитрофенилгидразонов.
ДИЗАМЕЩЕННЫЕ ГИДРАЗИНЫ
1,2-Дизамещенные гидразины
Отщепление азота при окислении 1,2-дизамещенных гидразинов 2а включает две стадии, и промежуточное соединение часто можно выделить, особенно когда R или R' (или же оба) — ароматические группы: