Методы выделения и анализа кумаринов в лекарственное растительное сырьё
Подлинность ЛВ методом ГЖХ можно подтвердить либо с помошью свидетелей, либо методом относительных удерживаний, В первом случае доказательством идентичности служит совпадение времени удерживания вешества-свидетеля и одного из компонентов смеси ЛВ при хроматографировании каждого в отдельности в одинаковых условиях. Во втором случае вещество-свидетель добавляют к пробе, затем анализируют по реком
ендуемой методике. Рассчитывают по формуле величину относительного удерживания, которая является постоянной для ЛВ в конкретных условиях. Количественный анализ выполняют в тех же условиях, используя для расчетов такие параметры, как площадь или высота пиков ЛВ. Площадь пиков устанавливают на хроматограмме с помощью планиметра, интегратора или умножением высоты пика на его полуширину.
Высокоэффективная жидкостная хроматография (ВЭЖХ) отличается от ГЖХ тем, что подвижной фазой служит не газ, а жидкость, причем она проходит через колонку, наполненную сорбентом, с большой скоростью за счет значительного давления. Поэтому ВЭЖХ позволяет разделять многокомпонентные смеси на индивидуальные вещества высокой степени чистоты. ВЭЖХ отличается высокой чувствительностью {до 10 6 г). На разделение 10-15 компонентов затрачивается 20-30 мин.
Жидкостный хроматограф включает такие узлы, как дозатор, насос высокого давления, высокоэффективная колонка, детектор с регистрирующим устройством. Колонки изготавливают из нержавеющей стали, они имеют длину 10-25 см, внутренний диаметр 0,3-0,8 см и плотно набиваются адсорбентом с размером частиц 5-10 мкм. В качестве элюента используют различные углеводороды в сочетании с этанолом. Детектором обычно служит спектрофотометр с переменной длиной волны (190-900 нм), но существуют также флуориметрические. электрохимические и другие детекторы.
Подлинность испытуемых ЛВ подтверждают по времени выхода каждого компонента смеси из колонки, которое будет стабильно при одинаковых условиях проведения эксперимента. Количественное содержание рассчитывается по площади пика, которая пропорциональна количеству ЛВ в пробе.(2)
4. Методы выделения кумаринов
Для выделения кумаринов из растений обычно применяются различные растворители: этанол, метанол, бензол, хлороформ, диэтиловый и петролейный эфиры или их комбинации.
4.1. Наиболее полная экстракция кумаринов (в свободной форме и в форме гликозидов) достигается при использовании спирта этилового различных концентраций, как на холоду, так и при нагревании. Для очистки суммы кумаринов от сопутствующих веществ густой экстракт, полученный после отгонки экстрагента, обрабатывают хлороформом, диэтиловым или петролейным эфиром. При использовании в качестве экстрагента петролейного эфира хорошо извлекается смесь фурокумаринов, которые после концентрирования экстракта можно выделить в кристаллическом состоянии. В ряде случаев дополнительно проводится обработка экстракта активированным углем, кипящей водой с последующим сгущением и дальнейшим извлечением гидроксилированных и метоксилированных кумаринов хлороформом, этилацетатом и бутанолом, непосредственная обработка сухого остатка смесью хлороформа — этиловый спирт (97:3) (для выделения аналогичных производных) или же используется само спиртовое извлечение. Например, для извлечения суммы 7-гидроксилированных кумаринов из корней Helianthus annum L. предложено проводить последовательную экстракцию ацетоном, смесью ацетон — метанол (1:1) с последующим освобождением от пигментов в делительной воронке смесью гексан — эфир (6:4). Иногда целесообразно растительный материал обрабатывать петролейным эфиром, а затем исчерпывающе экстрагировать хлороформом или метанолом. Для выделения пеуцеданина применяют экстракцию метанолом в аппарате Сокслета, аналогичным способом с использованием последовательной экстракции семян Angelica archangelica L. н-гексаном, дихлорметаном и метанолом и последующей препаративной ТСХ были выделены шесть производных фурокумарина. Эти же экстрагенты позволяют получить сумму кумаринов и фурокумаринов из растения Metrodorea flavida. Для выделения гидрокси-, алкоксикумаринов и их гликозидов из семян Aesculus hippocastanum L. применяется экстракция 80 % этиловым спиртом с последующей обработкой горячей водой, фильтрованием и многократным извлечением веществ хлороформом, этилацетатом и бутанолом. Эскулин и фраксин из коры каштана получали путем экстракции из метанола. В гексановых и метанольных извлечениях из побегов Kielmeyera reticulata Saad., полученных последовательно, обнаружены 4-фенилкумарины и 4-н-пропилкумарины.
4.2. Для очистки кумаринов от сопутствующих веществ возможно использование метода омыления. Для выделения кумаринов проводят:
1. Экстракцию ЛРС органическим растворителем (эфиром) получают сумму кумаринов и балластных веществ.
2. Эфирный слой отделяют, отработанное сырьё выбрасывают.
3. Полученное эфирное извлечение обрабатывают 0,5% водным раствором КОН для очистки от фенолов и кислот.
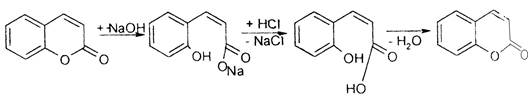
4. Затем это же извлечение обрабатывают 10% спиртовым раствором КОН. Происходит разрыв лактонного кольца и образуются кумарины, которые переходят в водный слой. А в органическом растворителе остаются балластные вещества (смолы, стерины, спирты), органическую фазу выбрасывают.
5. Водно-щелочной слой подкисляют разбавленной НСl. Происходит замыкание лактонного кольца, образуются кумарины, которые экстрагируют органическим растворителем.
6. Органический слой отгоняют - получают сумму кумаринов, которую разделяют хроматографически.
Существенными недостатками этого метода являются возможность образования вторичных продуктов распада кумаринов, дегидратации и изомеризации некоторых оксикумаринов.
Дальнейшие операции, как правило, направлены на разделение суммы кумаринов и выделение индивидуальных соединений. В ранних исследованиях использовались кристаллизация, фракционная перегонка или сублимация в высоком вакууме. Однако многие кумарины обладают сходной растворимостью в органических растворителях, поэтому даже многократная перекристаллизация не позволяет достичь надежного результата.
Поэтому дальнейшее развитие химии кумаринов привело к использованию для этих целей различных видов хроматографии, лишенных вышеуказанных недостатков.(6,7)
4.3 Хроматографическое определение:
Для обнаружения кумаринов в растениях и сырье используются лактоновые свойства кумаринов, их способность флуоресцировать при ультрафиолетовом освещении и давать окрашенные растворы со специальными реактивами, микросублимацию и хроматографический анализ экстрактов сырья.(1):
На пластинку "Силуфол" или хроматографическую бумагу наносят исследуемые экстракты и помещают в хроматографическую камеру с системой, указанной в НД на исследуемое сырье. Хроматограммы после высушивания просматривают в УФ-свете. Флуоресцирующие пятна кумаринов отмечают простым карандашом и хроматограммы обрабатывают щелочью. После этого их высушивают в сушильном шкафу при t=120°C и вновь просматривают в УФ-свете. Затем хроматограмму обрабатывают диазотированным сульфаниламидом, от действия которого кумарины в зависимости от структуры окрашиваются в оранжевый, красно-оранжевый, фиолетовый цвета.
Другие рефераты на тему «Химия»:
- Методы контроля и анализа веществ (химические методы)
- Разработка энергохимико-технологической системы (ЭХТС)
- Подготовка воды для производственных процессов. Изложение способов водоподготовки на предприятии
- Синтез и свойства комплексов рения (IV) с некоторыми аминокислотами
- Действие озона на насыщенные полимеры
