Нуклеофильное замещение у тетраэдрического атома углерода
Введение
Нуклеофильные реакции
Нуклеофильной называется реакция, в которой молекула органического вещества подвергается действию нуклеофильного реагента.
Нуклеофильные ("любящие ядро") реагенты, или нуклеофилы - это частицы (анионы или молекулы), имеющие неподеленную пару электронов на внешнем электронном уровне.
Примеры нуклеофильных част
иц:
OH, Cl, Br, CN, H2O, CH3OH, NH3.
Строение некоторых нуклеофильных реагентов
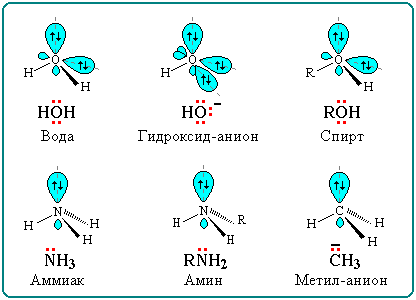
Благодаря подвижности π-электронов, нуклеофильными свойствами обладают также молекулы, содержащие π-связи:
CH2=CH2, CH2=CH–CH=CH2, C6H6 и т.п.
(Между прочим, это объясняет, почему этилен CH2=CH2 и бензол C6H6, имея неполярные углерод-углеродные связи, вступают в ионные реакции с электрофильными реагентами).
1.Примеры нуклеофильных реакций
Нуклеофильное замещение:
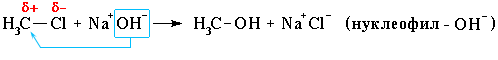
Механизм нуклеофильного замещения обозначается символом SN (по первым буквам английских терминов: S – substitution [замещение], N – nucleophile [нуклеофил]).
Нуклеофильное присоединение:
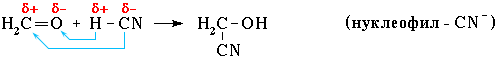
Обозначение механизма - AdN (Ad – addition [присоединение]).
2.Мономолекулярное нуклеофильное замещение и отщепление
Нуклеофильное замещение при насыщенном атоме углерода — это тот тип органических реакций, механизмы которого изучались наиболее подробно. Возможность широкого, варьирования структуры реагентов, одновременного исследования кинетических и стереохимических закономерностей, удобство экспе риментального измерения констант скорости в разнообразных-растворителях — все это сделало реакции нуклеофильного замещения удобным модельным процессом для установления общих закономерностей, связывающих строение органических соеди-: нений с их реакционной способностью. Не случайно, что именно при изучении этих реакций были сформулированы многие общие концепции, ставшие основой теоретической органической химии. Следует иметь в виду, что понятия, которые будут формулиро ваться и анализироваться в последующих двух главах, имеют общее значение и могут быть использованы для описания реакционной способности органических соединений и в других типах органических процессов. Закономерности, характеризующие; реакции нуклеофильного замещения, в значительной степени могут быть перенесены и на другие нуклеофильные процессы :реакции отщепления, замещения в ароматическом ряду, присоединения по кратным связям и многие другие.
Наше внимание будет сосредоточено на двух основных проблемах. Во-первых, мы постараемся понять, каким образом механизм реакции зависит от строения реагирующих соединений и условий ее проведения. Во-вторых, мы должны научиться предсказывать, каким образом изменяется реакционная способность при изменении строения реагентов и условий проведения реакции!Как мы увидим, эти зависимости могут быть совершенно различными для реакций, идущих по разным механизмам. Это может приводить не только к качественно различному влиянию изменения структурных факторов на скорость процесса, но и к полному изменению его направления. Далее нами будет показано, как можно закономерности, рассмотренные в этой и следующей главах, использовать для описания других процессов.
3.ОБЩИЕ ПРЕДСТАВЛЕНИЯ О МЕХАНИЗМАХ РЕАКЦИЙ НУКЛЕОФИЛЬНОГО ЗАМЕЩЕНИЯ
В общем виде реакцию нуклеофильного замещения можно представить следующей схемой: R-Xm + Yn → R-Yn+1+ Xm-1
В качестве нуклеофильного агента Y может выступать как анион, так и нейтральная молекула, обладающая хотя бы одной неподеленной парой электронов (т. е. основание Льюиса), например:
Y = H2O, ROH, H2S, RSH, NH3, NR., OH", OR", SH~, SIT, Hal", CN~, SCN-, NO2, RCOCT. RC=-CHR и т д.
Замещаемая группа X (называемая уходящей группой) обычно обладает высокой электроотрицательностыо и может уходить как в виде аниона, так и в виде незаряженной молекулы, отщепляясь с электронами нарушающейся связи:
Х=На1, ОН, OR,
OSO2R, OCOR, NR3, SR2 и т. д.
Следует иметь в виду, что в большинстве случаев реакции нуклеофильного замещения сопровождаются конкурирующими с ними реакциями нуклеофильного отщепления, так как нуклео-фильиый реагент может взаимодействовать не только с положительно заряженным атомом углерода, но и с атомом водорода, находящимся в положении, отщепляя его в виде протона. В связи с этим многие аспекты реакций замещения и отщепления будут рассматриваться параллельно.
Реакции нуклеофильного замещения обозначаются как Sn, а отщепления — En.
Как мы увидим, реакция замещения при С может осуществляться как диссоциативный или как синхронный процесс. В первом случае реакция начинается с мономолекулярной диссоциации по связи С—X с образованием карбкатиона, который на второй стадии взаимодействует с нуклеофильным реагентом.
Во втором случае образование связи с нуклеофильным реагентом и разрыв связи с уходящей группой осуществляются одновременно, и процесс идет в одну стадию:
RX + Y- --► [X6--R-Ye'-l4fc--- RY + X-.
Можно рассмотреть еще один механизм реакции, при котором процесс осуществляется как двухстадийный: за счет атаки куклеофила на молекулу субстрата образуется пентаковалент-ный интермедиат и затем происходит отщепление уходящей группы. Для замещения при атоме углерода этот механизм маловероятен, так кок требует расширения электронной оболочки атома углерода до десяти электронов. Есть указания, что в газовой фазе анионы СХ5 могут быть достаточно устойчивы, однакоз и в этом случае они, по-видимому, не имеют симметричного] строения, и замещение идет через переходное состояние, анало-i гичное имеющему место в случае синхронного процесса. В реакциях в растворе двухстадийиый accoциативный механизм не осуществляется. О том, что реакции нуклеофильного замещения действительно могут осуществляться по двум различным механизмам, свидетельствуют как стереохимические, так и кинетические данные.
4.Стереохимическое течение реакций нуклеофильного замещения.
При исследовании реакций нуклеофильного замещения y асимметрического атома углерода было показано, что в зависимости от строения исходных реагентов и условий проведения реакции стереохимическое течение реакции может быть различным. Так, при проведении следующего цикла реакций оптическая активность практически полностью сохраняется, но знак вращения изменяется на противоположный.
На первой и третьей стадиях реакции связи асимметрического атома углерода не затрагиваются и, следовательно, eго конфигурация остается неизменной. Отсюда следует, что вторая стадия — замещение п-толуолсульфонатной группы на ацетат- анион — происходит с полным обращением конфигурации у акционного центра (вальденовское обращение).
