Затвердевание сплавов. Строение жидкого металла. Термодинамические стимулы и кинетические возможности процесса затвердевания. Влияние переохлаждения и примесей на процесс кристаллизации
1. Жидкое и твёрдое состояние
Все вещества могут находиться в трёх агрегатных состояниях: твёрдое, жидкое и газообразное. Переход между ними сопровождается скачкообразным изменением свободной энергии, энтропии, плотности и других физических свойств.
Реализация агрегатного состояния вещества зависит от температуры (Т) и давления (Р), при которых оно находится.
В газах межмол
екульные расстояния большие, молекулы не взаимодействуют друг с другом. У газа отсутствует объём и форма.
Жидкости и твёрдые тела имеют постоянный, собственный объём (т. к. атомы взаимодействуют друг с другом).
В жидкости происходят малые колебания атомов вокруг равновесных положений и частые перескоки из одного равновесного положения в другое. Жидкое состояние характеризуется ближним порядком в расположении атомов. Жидкости характерна некоторая зависимость в расположении атомов; характерное свойство жидкости – текучесть. Ближний порядок динамически неустойчив. С повышением температуры размеры объемов с ближним порядком (фазовых флуктуаций), уменьшаются.
Атомы в твердом теле совершают только малые колебания около своих равновесных положений. Это приводит к правильному чередованию атомов в пространстве на одинаковых расстояниях для сколь угодно далеко удаленных атомов, т.е. существует дальний порядок в расположении атомов; образуется кристаллическая решетка. Твердому телу характерна стабильная, постоянная форма.
2. Термодинамические условия кристаллизации
Переход металла из жидкого состояния в твёрдое (кристаллическое) называется кристаллизацией.
Кристаллизация (или плавление) протекает в условиях, когда система переходит к термодинамическому более устойчивому состоянию с меньшей свободной энергией.
Энергетическое состояние системы, характеризуется термодинамической функцией F, называемой свободной энергией (это только часть системы):
F = U – TS,
где U – полная энергия;
T – абсолютная температура К0;
S – энтропия (характеризует степень порядка; чем больше беспорядок, тем больше энтропия).
Изменение свободной энергии жидкого и твердого состояний в зависимости от температуры показано на рис. 1.
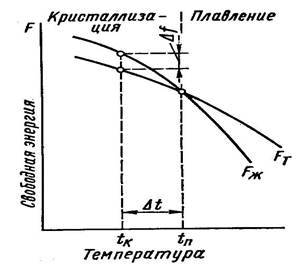
Рисунок 1. Изменение свободной энергии металла в жидком (FЖ), в твердом (FТ) состоянии в зависимости от температуры
Система с большой свободной энергией менее устойчива, и, следовательно, стремится перейти к устойчивому состоянию с минимальной свободной энергией. Выше температуры ТП устойчив жидкий металл (при Т1 →Fж<Fт), имеющий меньший запас свободной энергии, ниже этой температуры устойчив твердый металл (при Тк → Fт< Fж).
При ТП величины свободных энергий жидкого и твердого состояний равны: Fж = Fт. Температура ТП – равновесная температура кристаллизации (плавления) вещества, при которой обе фазы (жидкая и твердая) могут (Fж= Fт) существовать одновременно и бесконечно долго. Процесс кристаллизации при этой температуре не начинается.
Кристаллизация начнется, при создании специальных условий, когда возникнет разность свободных энергий Δf, то есть вследствие уменьшения свободной энергии твердого металла по сравнению жидким.
Следовательно, процесс кристаллизации может протекать только при переохлаждении металла ниже ТП.
Разность между температурами ТП и Тк, при которых может протекать кристаллизация, носит название степени переохлаждения:
Δ Т = ТП – Т к
где Т к – фактическая температура кристаллизации.
Кристаллизация может характеризоваться термическими кривыми охлаждения (рис. 2). Рассмотрим процесс кристаллизации чистых металлов с разной скоростью охлаждения.
Скорость V1 – очень медленное охлаждение, степень переохлаждения ΔТ1 – невелика, кристаллизация протекает при температуре близкой к равновесной ТП.
На кривой охлаждения имеется горизонтальная площадка, образование которой объясняется выделением скрытой теплоты кристаллизации, несмотря на отвод теплоты при охлаждении.
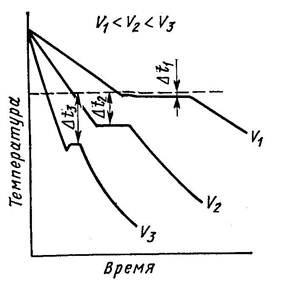
Рисунок 2. Кривые охлаждения при кристаллизации металла
С увеличением скорости охлаждения (V2, V3) степень переохлаждения возрастает, кристаллизация протекает при температуре значительно ниже равновесной ТП. Для металлов степень переохлаждения обычно 10–300С.
Процесс кристаллизации, как установил Д.К. Чернов, начинается с образования кристаллических зародышей (центров кристаллизации) и продолжается в процессе роста их числа и размеров. Таким образом, процесс кристаллизации состоит из двух элементарных процессов: 1-й – зарождение зародышей, 2-й – их рост. В первоначальный момент кристаллы растут свободно, имея правильную форму; однако при столкновении растущих кристаллов их правильная форма нарушается.
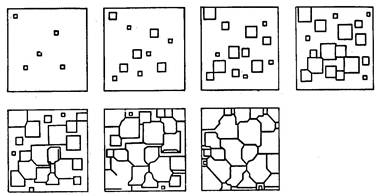
Рисунок 3. Схема кристаллизации металла
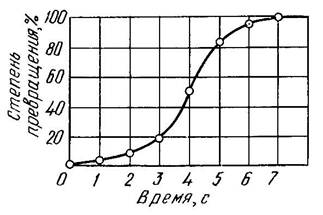
Рисунок 4. Кинетическая кривая кристаллизации
3. Самопроизвольное образование зародышевых центров
Наиболее сложным в процессе кристаллизации является представление по зарождению центров кристаллизации. С понижением температуры степень ближнего порядка в жидкости и размер таких микрообъемов возрастают. При температуре близких к Тк (ТП), в жидком металле возможно образование небольших группировок, в которых атомы упакованы так же, как и в кристаллах. Такие группировки называют фазовыми (или гетерофазными) флуктуациями. Эти флуктуации превращаются в зародыши (центры кристаллизации).
Возникающие зародыши могут быть различной величины. Рост зародышей возможен, если они достигли определенной величины, начиная с которой их рост ведет к уменьшению свободной энергии (рис. 5).
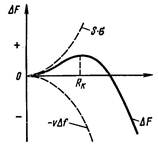
Рисунок 5. Изменение свободной энергии металла при образовании зародышей кристалла в зависимости от их размера
Изменение свободной энергии:
ΔFобщ = – VΔf + Sσ
где V – объем зародыша,
Δf – разность (Fж – Fт) металла,
S – суммарная величина поверхности кристаллов,
σ – поверхностное натяжение.
В процессе кристаллизации свободная энергия системы, с одной стороны уменьшается за счет перехода жидкого металла в твердый на VΔf, а с другой стороны, возрастает в результате образования поверхности раздела с избыточной поверхностной энергией, равной Sσ.
Минимальный размер зародыша Rк, способного к росту при данных температурных условиях, называется критическим размером зародыша (зародыш – критический или равновесный): Rк= 2σ/Δf.
С увеличением степени переохлаждения Rк уменьшается (за счет увеличения Δf) (рис. 6), и следовательно возрастает число зародышей (центров) кристаллизации и скорость образования этих зародышей.
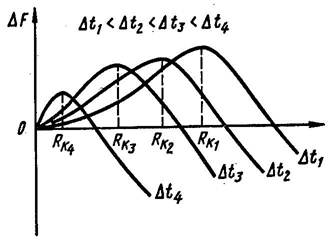
Рисунок 6. Изменение свободной энергии металла при образовании зародышей кристалла в зависимости от степени переохлаждения
Другие рефераты на тему «Производство и технологии»:
Поиск рефератов
Последние рефераты раздела
- Технологическая революция в современном мире и социальные последствия
- Поверочная установка. Проблемы при разработке и эксплуатации
- Пружинные стали
- Процесс создания IDEFO-модели
- Получение биметаллических заготовок центробежным способом
- Получение и исследование биоактивных композиций на основе полиэтилена высокой плотности и крахмала
- Получение титана из руды
