Адсорбция и адсобционные равновесия
1. Адсорбция локализована на отдельных адсорбционных центрах, каждый из которых взаимодействует только с одной молекулой адсорбента - образуется мономолекулярный слой.
2. Адсорбционные центры энергетически эквивалентны - поверхность адсорбента эквипотенциальна.
3. Адсорбированные молекулы не взаимодействуют друг с другом.
Ленгмюр предположил, что при адсорбции происходит квазихимиче
ская реакция между распределяемым компонентом и адсорбционными центрами поверхности:
![]() ,
,
где А - адсорбционые центры поверхности;
В - распределенное вещество;
АВ - образующийся комплекс на поверхности.
Константа равновесия процесса: ![]() ,
,
где сав = А - величина адсорбции;
са = А0 = А¥ - А,
где А¥ - емкость адсорбционного монослоя или число адсорбционных центров, приходящихся на единицу поверхности или единицу массы адсорбента; А0 - число оставшихся свободных адсорбционных центров, приходящихся на единицу площади или единицу массы адсорбента; св – концентрация распределенного вещества.
Подставляя величину концентрации в уравнение константы, получим выражения
![]() , св = с,
, св = с,
А = А¥Кс – АКс, ![]() - для жидкостей;
- для жидкостей;
![]() - для газов.
- для газов.
Эти выражения – уравнения изотермы адсорбции Ленгмюра. К и Кр в уравнении характеризуют энергию взаимодействия адсорбента с адсорбатом. Адсорбционное уравнение часто представляют относительно степени заполнения поверхности, т.е. как отношение А/А¥:
![]() ,
,
![]() .
.
Экспериментальные результаты по определению изотермы адсорбции обычно обрабатывают с помощью уравнения, записанного в линейной форме;
![]() , т.е. уравнение типа y = b + ax.
, т.е. уравнение типа y = b + ax.
Такая линейная зависимость позволяет графически определить А¥ и К. Зная А¥, можно определить удельную поверхность адсорбента (поверхность единицы массы адсорбента):
![]() ,
,
где А¥ - предельная адсорбция, выражаемая числом молей адсорбата на единицу массы адсорбента;
NA – число Авогадро;
w0 – площадь, занимаемая одной молекулой адсорбата.
1. Если сà 0, тогда уравнение примет вид:
А=А¥Кс; ![]() ; А = Кгс, q =Кс,
; А = Кгс, q =Кс,
т.е. при сà 0 уравнение Ленгмюра переходит в уравнение Генри.
2. Если сà¥, тогда А = А¥ , А/А¥ = 1. Это случай предельной адсорбции.
3. Пусть адсорбция идет из смеси компонентов, в этом случае уравнение Ленгмюра записывается следующим образом:
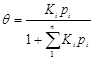 .
.
Все рассмотренные выше уравнения справедливы для мономолекулярной адсорбции на адсорбенте с энергетически эквивалентными адсорбционными центрами. Однако реальные поверхности этим свойством не обладают. Приближенной к реальности является возможность распределения адсорбционных центров по энергии. Приняв линейное распределение, Темкин использовал формулу уравнения Ленгмюра и получил уравнение для средних степеней заполнения адсорбента.
![]() ,
,
где - константа, характеризующая линейное распределение;
К0 - константа уравнения Ленгмюра, отвечающая максимальной теплоте адсорбции.
Из уравнения следует, что увеличение парциального давления (из-за увеличения концентрации) одного компонента подавляет адсорбцию другого и тем сильнее, чем больше его адсорбционная константа равновесия. Уравнение часто называют логарифмической изотермой адсорбции. Если принять экспоненциальное распределение центров по поверхности, то в области средних заполнений получается ранее найденное эмпирическим путем уравнение Фрейндлиха:
![]() .
.
Прологарифмировав, получим ![]() ,
,
где K, n – постоянные.
Использование уравнения Фрейндлиха в логарифмической форме позволяет определить константу уравнения.
Уравнение Ленгмюра можно использовать только при адсорбции в мономолекулярном слое. Это условие выполняется при хемосорбции, физической адсорбции газов при меньшем давлении и температуре выше критической.
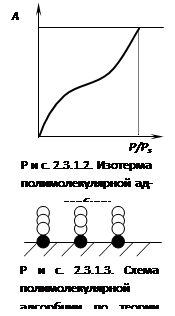 Однако в большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию и поэтому остается возможность влияния поверхностных сил на второй и т.д. адсорбционные слои. Это реализуется в том случае, когда газы и пары адсорбируются при температуре ниже критической, т.е. образуются полимолекулярные слои на поверхности адсорбента, что можно представить как вынужденную конденсацию (рис. 2.3.1.2 и 2.3.1.3).
Однако в большинстве случаев мономолекулярный адсорбционный слой не компенсирует полностью избыточную поверхностную энергию и поэтому остается возможность влияния поверхностных сил на второй и т.д. адсорбционные слои. Это реализуется в том случае, когда газы и пары адсорбируются при температуре ниже критической, т.е. образуются полимолекулярные слои на поверхности адсорбента, что можно представить как вынужденную конденсацию (рис. 2.3.1.2 и 2.3.1.3).
В результате этих представлений была выведена следующая формула:
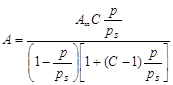 - уравнение полимолекулярной адсорбции БЭТ,
- уравнение полимолекулярной адсорбции БЭТ,
где ![]() ;
;
KL = aж/ап – константа конденсации пара;
аж - активность вещества в жидкости;
ап - активность вещества в состоянии насыщенного пара;
ап = Рs.
Физический смысл С: характеризует разность энергии Гиббса в процессах чистой адсорбции и конденсации. Это уравнение получило название БЭТ (Бранауэр-Эммет- Теллер).
При р/рs<<1, уравнение БЭТ превращается в уравнение Легмюра, которое при дальнейшем уменьшении давления (Рà 0) переходит в закон Генри:
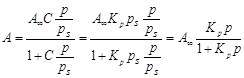 .
.
При обработке экспериментальных данных уравнение БЭТ используют в линейной форме (рис. 2.3.1.4):

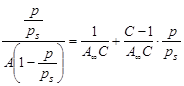 ;
; ![]() ,
,
таким образом графически находят обе константы уравнения А¥ и С.
