Адсорбция и адсобционные равновесия
Для адсорбентов переходной пористости характерна изотерма адсорбции с петлей капиллярно-конденсационного гистерезиса (рис. 2.3.2.1). При малых давлениях, когда конденсация не происходит, гистерезис не наблюдается. Начало его появления зависит от природы адсорбента и адсорбата.
Пористые структуры разнообразны, однако считается, что их можно смоделировать тремя видами:
1) конусообразные;
2) цилиндрические с одним открытым концом;
3) цилиндрические с двумя открытыми концами.
В реальных адсорбентах имеются все виды пор, которые заполняются при разных давлениях, поэтому реальные изотермы имеют вид, представленный на рис. 2.3.2.2:
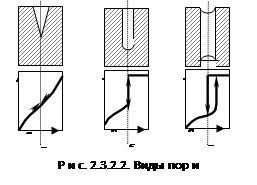

В первой группе в конусообразных порах конденсация начинается со дна пор, где кривизна наибольшая. По мере заполнения поры радиус мениска увеличивается (уменьшается кривизна), поэтому для дальнейшего заполнения поры необходимо увеличить давление (рис. 2.3.2.2, а). Процесс десорбции идет в обратном направлении и описывается той же кривой.
Во второй группе конденсация также начинается со дна, где кривизна сферическая и поэтому наибольшая (см. рис. 2.3.2.2, б). Так как пора цилиндрическая, то она заполняется целиком при определенном радиусе мениска, что отвечает и определенному давлению пара. Капиллярная конденсация в этих порах также происходит обратимо. В третьей группе (в): конденсация начинается на стенках пор, имеющих кривизну, в 2 раза меньшую сферы того же радиуса. Поэтому заполнение происходит при больших давлениях пара. Конденсация на стенках приводит к уменьшению радиуса пор и ее мгновенному заполнению при давлении, отвечающем началу конденсации. На концах образуются сферические мениски жидкости. Десорбция может начаться при давлении, соответствующем радиусу кривизны этих менисков. Таким образом, опорожнение происходит при меньшем давлении, чем ее заполнение. Это и объясняет наличие гистерезиса на изотерме адсорбции. В некоторых случаях гистерезис вызывается кинетическими факторами (смачивание).
Капиллярная конденсация описывается уравнением Кельвина, в которое входит радиус кривизны мениска. Это позволяет рассчитывать функции распределения пор по размерам. В принципе количественная характеристика дисперсных систем по дисперсности может быть представлена распределением массы, объема, размером частиц по радиусу поверхности. Метод расчета функции распределения частиц (пор) по размерам заключается в построении интегральных и дифференциальных кривых распределения. Для простых тел наиболее типичными является распределение пор по радиусу. Поэтому интегральная кривая распределения выражает зависимость общего объема пор от их радиуса: Vn=f(r).
Из кривой (рис. 2.3.2.3, а) видно, что общий объем малых пор относительно небольшой. Однако доля поверхности, приходящаяся на эти поры, существенно велика. С увеличением размера пор объем увеличивается быстрее, чем поверхность. Построение разных кривых распределения позволяет более правильно представить структуру пористого тела.

Размеры микропор соизмеримы с размерами адсорбированных молекул. В отличие от Ленгмюровского микрослоя в микропорах молекулы расположены в основном вдоль поры и взаимодействуют друг с другом подобно взаимодействию с полимолекулярными слоями преобразования. Но в отличие от последнего большинство молекул находится в непосредственном контакте со стенками пор. Поэтому ни теория БЭТ, ни теория Ленгмюра для процесса адсорбции микропористыми телами неприемлемы. Закономерности заполнения микропор также нельзя описать теорией капиллярной конденсации. Это объясняется перекрыванием полей поверхностных сил в противоположных стенках, что значительно увеличивает энергию адсорбции. Гистерезис в микропорах обычно не наблюдается. Особенность адсорбции на микропористых телах проявляется в их избирательном действии. Это происходит благодаря тому, что большинство адсорбированных молекул взаимодействует непосредственно с поверхностью. Кроме этого у микропор наблюдается так называемый ситовый эффект. Суть его в том, что адсорбируются только те молекулы, размер которых меньше или равен радиусу пор. Поэтому микропористые адсорбенты часто называют молекулярными ситами. В основе количественных соотношений теории объемного заполнения пор лежит теория Поляни. Утверждается следующее.
1. В адсорбционном пространстве действуют только дисперсионные силы, которые аддитивны и не зависят от температуры. Т.е. при адсорбции характер взаимодействия между молекулами адсорбата не изменяется, а происходит только увеличение концентрации на поверхности адсорбента.
2. Активных центров нет, а есть непрерывное силовое поле.
3. Адсорбционные силы действуют на расстоянии большем, чем монослой адсорбата, поэтому говорят об абсорбционном объеме, который заполняется жидким адсорбатом.
4. Действие адсорбционных сил уменьшается по мере удаления от адсорбента и на каком-то расстоянии они равны нулю.
5. Притяжение данной молекулы поверхностного адсорбента не зависит от наличия в адсорбционнои пространстве других молекул, вследствие этого возможна полимолекулярная адсорбция.
6. Адсорбционные силы не зависят от температуры. И, следовательно, с изменением температуры адсорбционный объем не изменяется. Это не противоречит тому, что с увеличением температуры адсорбция уменьшается, а свидетельствует о том, что в результате нагревания и увеличения интенсивности теплового движения адсорбированных молекул увеличивается десорбция.
На рис. 2.3.2.4 показан разрез адсорбционного объема. Как во всяком поле, в них можно представить эквипотенциальные поверхности, т.е. поверхности, где адсорбционный потенциал постоянен - это пунктирные линии.

Под адсорбционным потенциалом e следует понимать работу, совершаемую против адсорбционных сил при перемещении одного моля газа с поверхности жидкого адсорбата (рs) в газовую фазу (р). В теории Поляни сделано допущение, что практически все адсорбированное вещество находится в жидком состоянии. Это позволяет заменить зависимость адсорбционного потенциала от расстояния (которое для пористого адсорбента определить невозможно) на функцию объемного жидкого адсорбента. Этот объем можно определить из экспериментально полученной изотермы адсорбции (рис. 2.3.2.5), дающей величину адсорбции:
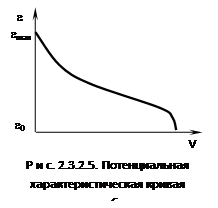
V = AVm,
где V - адсорбционный объем, заполненный жидкостью;
А - величина адсорбции, моль;
Vm - мольный объем адсорбата.
![]() ,
,
т.е. адсорбционный потенциал при постоянном объеме не зависит от температуры. Это так называемая температурная инвариантность. Для двух разных температур можно записать:
Другие рефераты на тему «Химия»:
- Основные химические законы и их использование в химической промышленности
- Перхлораты и их использование
- Влияние модифицированной полиметакриловой кислоты, ковалентно связанной с порфирином, на его кислотно-основные свойства
- Мутации структуры белковоподобного сополимера. Компьютерное моделирование
- Полистирол
