Азот и его соединения
Содержание
Введение
Азот (общие сведения)
Соединения азота
Аммиак
Нитрит натрия
Нитрит калия
Нитрат кальция
Физические свойства
Химические свойства
Получение
Распространенность в природе
Применение
История открытия
Вывод: краткое содержание
Использованная литература
Введение
Основная масса азота на Земле находится в г
азообразном состоянии и составляет свыше 3/4 атмосферы (78,09% по объему, или 75,6% по массе). Практически на нашей планете за - пас азота неисчерпаем - 3,8*10^15 т. Азот - довольно инертный элемент, поэтому редко встречается в связанном состоянии. Это один из основных биофильных элементов, не - обходимый компонент главных полимеров живых клеток - структурных белков, белков - ферментов, нуклеиновых и аде - нозинтрифосворных кислот. Никакой другой элемент так не лимитирует ресурсы питательных веществ в агроэкосистемах, как азот. Он может стать доступным для живых организмов только в связанной форме, то есть в результате азотофиксации.
Азотофиксация - биологический процесс, и единственными организмами, способными его осуществлять, служат прокариоты (бактерии, цианобактерии, актиномицеты и архебактерии).
Небиологические процессы фиксации азота (грозовые разряды, воздействие УФ-лучей, работа электрического оборудования и двигателей внутреннего сгорания) в количественном отношении весьма несущественны, так как вместе дают не более 0.5% связанного азота. Даже вклад заводов азотных удобрений, производящих синтетический аммиак составляет лишь 5%.
Следовательно, свыше 90% всей фиксации молекулярного азота атмосферы осуществляется вследствие метаболической активности определённых микроорганизмов.
Впервые бактерии рода азотобактер, а точнее Azotobacter chroococcum были открыты голландским микробиологом М. Бейеринк в 1901 году.
Азот (общие сведения)
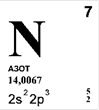
АЗОТ (лат. Nitrogenium - рождающий селитры), N (читается "эн") - химический элемент второго периода VA группы периодической системы, атомный номер 7, атомная масса 14,0067. В свободном виде - газ без цвета, запаха и вкуса, плохо растворим в воде. Состоит из двухатомных молекул N2, обладающих высокой прочностью. Относится к неметаллам.
Природный азот состоит из стабильных нуклидов 14N (содержание в смеси 99,635% по массе) и 15N. Конфигурация внешнего электронного слоя 2 s 22р 3. Радиус нейтрального атома азота 0,074 нм, радиус ионов: N3 - 0,132, N3+- 0,030 и N5+- 0,027 нм. Энергии последовательной ионизации нейтрального атома азота равны, соответственно, 14,53, 29,60, 47,45, 77,47 и 97,89 эВ. По шкале Полинга электроотрицательность азота 3,05.
Соединения азота
НИТРАТЫ - соли азотной кислоты HNO3, твердые хорошо растворимые в воде вещества. Традиционное русское название некоторых нитратов щелочных и щелочноземельных металлов и аммония - селитры (аммонийная селитра NH4NO3, калийная селитра КNO3, кальциевая селитра Са (NO3) 2и др.
НИТРИДЫ - химические соединения азота с более электроположительными элементами. Нитриды алюминия, бора, кремния, вольфрама, титана (AlN, BN, Si3N4, W2N, TiN) и многие другие - тугоплавкие, химические стойкие кристаллические вещества. Компоненты жаропрочных сплавов используются в полупроводниковых приборах (напр., полупроводниковых лазерах, светоизлучающих диодах), как абразивы. Действием азота или аммиака на металлы при 500-600 °С получают нитридные покрытия (высокотвердые, износо- и коррозионностойкие).
АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы), сесквиоксид N2O3(синяя жидкость), диоксид NO2(бурый газ, при обычных условиях смесь NO2и его димера N2O4), оксид N2O5(бесцветные кристаллы). N2O и NO - несолеобразующие оксиды, N2O3с водой дает азотистую кислоту, N2O5- азотную, NO2- их смесь. Все оксиды азота физиологически активны. N2O - средство для наркоза ("веселящий газ"), NO и NO2- промежуточные продукты в производстве азотной кислоты, NO2- окислитель в жидком ракетном топливе, смесевых ВВ, нитрующий агент.
Аммиак
NH3M=17,03
Встречается при очистке воды, керосина и некоторых минеральных масел; на сахарных заводах; при дублении кожи; в воздухе помещений, где стоит скот; входит в состав клоачных газов (вместе с сероводородом); содержится в неочищенном ацетилене.
Применяется для производства азотной кислоты, нитрата и сульфата аммония, жидких удобрений (аммиакатов), мочевины, соды, в органическом синтезе, при крашении тканей, светокопировании (на диазониевой бумаге), в качестве хладагента в холодильниках, при серебрении зеркал.
Получается прямым синтезом из газообразных водорода и азота при давлении обычно 280-350 ат и 450-500° (в присутствии катализаторов). В меньших количествах получается при коксовании каменного угля перегонкой с известью "аммиачной воды" (первая фракция при сухой перегонке угля).
Физические и химические свойства. Бесцветный газ с удушливым резким запахом (порог восприятия 0,037 мг/л) и едким вкусом. Т. плавл. - 77,75°; т. кип. - 33,35°; плоти.0,771 г/л (0°), 0,59 г/л (25°). Раств. в воде около 750г/л, или 526 г/л; коэфф. раств. в воде 762,6. Растворим в эфире и других органических растворителях. Пределы взрывоопасных концентраций в воздухе 15 - 28%, в кислороде 13,5--79%, в закиси азота 2,2-72%. На воздухе NH3 быстро переходит в (NH4) 2CO3 или поглощается влагой. При обычной температуре устойчив. Весьма реакционноспособен, вступает в реакции присоединения, замещения и окисления. Водный раствор, имеет щелочную реакцию вследствие образования гидрата окиси аммония NH*H. В продажу поступает в виде водных растворов, содержащих 28-29% (объемн) NH3, 10% раствора NH3 (нашатырный спирт) или сжиженного NH3 в стальных цилиндрах.
Нитрит натрия
NaNO2 М = 69,00
Применяется в производстве органических красителей; в пищевой промышленности; для пассивирования стальных изделий; в резиновой и текстильной промышленности, в гальванотехнике. Получается абсорбцией раствором соды нитрозных газов производства азотной кислоты и очисткой, упариванием и кристаллизацией полученной емки нитрита и нитрата натрия.
Физические и химические свойства. Бесцветные или желтоватые кристаллы. Т. плавл.271°; плоти.2,17: выше 320° разл., не доходя до кипения; раств. в воде 81,8 г/ЮО г (20°).163 г/ЮО г *О'). Токсическое действие. Вызывает расширение сосудов вследствие пареза сосуда - двигательного центра (при больших дозах - и вследствие непосредственного действия на кровеносные сосуды), а также образование в крови метгемоглобина.
Натриевая селитра, чилийская селитра.
NaNO3 М = 84.99
Применяется как удобрение; в пищевой, стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей.
Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
