Влияние температуры на скорость химической реакции
Влияние температуры на скорость
Правило Вант-Гоффа: при повышении Т на ![]() скорость хим. реакции увеличивается в 2-4 раза. Математически это правило можно записать:
скорость хим. реакции увеличивается в 2-4 раза. Математически это правило можно записать: ![]() ,
, ![]() ,
, c="images/referats/5186/image004.png">
![]() - температурный коэффициент хим. реакции. Правило Вант-Гоффа является приближённым и его обычно используют для приблизительно оценки скорости при изменении температуры. Более точным является уравнение Аррениуса, по которому:
- температурный коэффициент хим. реакции. Правило Вант-Гоффа является приближённым и его обычно используют для приблизительно оценки скорости при изменении температуры. Более точным является уравнение Аррениуса, по которому:![]() . Они могут быть вычислены по значению констант скорости при 2-х различных Т. При
. Они могут быть вычислены по значению констант скорости при 2-х различных Т. При ![]() :
: ![]() (1). При
(1). При ![]() :
: ![]() (2). Вычитая из (1) (2) получаем
(2). Вычитая из (1) (2) получаем ![]() . Отсюда можно выразить А. Зная А, по уравнению (1) или (2) вычисляют В. Уравнение Аррениуса может быть получено т/д-им выводом из уравнения изобары (изохоры) хим. реакции. Опуская индексы, характеризующие условия протекания реакции, это уравнение записывается:
. Отсюда можно выразить А. Зная А, по уравнению (1) или (2) вычисляют В. Уравнение Аррениуса может быть получено т/д-им выводом из уравнения изобары (изохоры) хим. реакции. Опуская индексы, характеризующие условия протекания реакции, это уравнение записывается: ![]() ,
, ![]() , где
, где ![]() и
и ![]() - константы скорости прямой и обратной реакции. Учитывая эти уравнения можно записать:
- константы скорости прямой и обратной реакции. Учитывая эти уравнения можно записать: ![]() . Представим тепловой эффект реакции Q как разность 2-х энергетических величин:
. Представим тепловой эффект реакции Q как разность 2-х энергетических величин: ![]() . Тогда последнее уравнение можно записать в виде:
. Тогда последнее уравнение можно записать в виде: ![]() . С точностью до некоторой постоянной величины можно записать:
. С точностью до некоторой постоянной величины можно записать: ![]() ,
, ![]() . Опыт показывает что
. Опыт показывает что ![]() . Отбрасывая индексы, последнее уравнение записывается:
. Отбрасывая индексы, последнее уравнение записывается: ![]() (1), где К – константа скорости хим. реакции. Энергетическая величина Е в этом уравнение называется энергией активации. Полученное уравнение описывает зависимость К хим. реакции от температуры. Разделив переменные и проинтегрировав, получим:
(1), где К – константа скорости хим. реакции. Энергетическая величина Е в этом уравнение называется энергией активации. Полученное уравнение описывает зависимость К хим. реакции от температуры. Разделив переменные и проинтегрировав, получим: ![]() ,
, ![]() (2).
(2).
Уравнение (2) по форме походит на уравнение Аррениуса, интегрируя (2) получим: 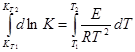 ,
, ![]() (3).
(3).
Уравнение используют либо для вычисления энергии активации по известным константам скорости при двух температурах, либо для вычисления константы скорости реакции при неизменной температуре, если известна энергия активации. Для большинства хим. реакций энергия активации определяется в пределах ![]() . Физический смысл энергии активации раскрывается в теории химической кинетики, её можно определить как некоторый избыток энергии по сравнению со средним значением для денных условий, которыми должны обладать молекулы чтобы вступить в хим. реакцию. Уравнение (2) чаще представляют в виде:
. Физический смысл энергии активации раскрывается в теории химической кинетики, её можно определить как некоторый избыток энергии по сравнению со средним значением для денных условий, которыми должны обладать молекулы чтобы вступить в хим. реакцию. Уравнение (2) чаще представляют в виде: ![]() . При этом
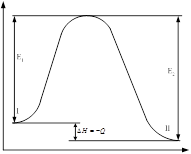
. При этом ![]() называют предэкспоненциальным множителем. Связь энергии активации с тепловым эффектом можно проиллюстрировать с помощью представлению о энергетическом барьере, который разделяет начальное и конечное состояние системы. I и II – уровни энергии вещ-в исходных и продуктов реакции.
называют предэкспоненциальным множителем. Связь энергии активации с тепловым эффектом можно проиллюстрировать с помощью представлению о энергетическом барьере, который разделяет начальное и конечное состояние системы. I и II – уровни энергии вещ-в исходных и продуктов реакции. ![]() - энергия активации прямой реакции.
- энергия активации прямой реакции. ![]() - энергия активации обратной реакции. Избыток энергии реагирующих молекул, названный энергией активации, необходим для преодоления отталкивания электронных облаков взаимодействующих молекул при их столкновении, и для разрыва старых связей молекул. Уравнение Аррениуса справедливо в области невысоких температур; при достаточно высоких температурах константа скорости перестаёт зависеть от температуры.
- энергия активации обратной реакции. Избыток энергии реагирующих молекул, названный энергией активации, необходим для преодоления отталкивания электронных облаков взаимодействующих молекул при их столкновении, и для разрыва старых связей молекул. Уравнение Аррениуса справедливо в области невысоких температур; при достаточно высоких температурах константа скорости перестаёт зависеть от температуры.
Теория активных столкновений
Для начала реакции необходимо столкновение реагирующих молекул. Но не каждое из столкновений заканчивается хим. взаимодействием. И хим. реакция всегда протекает со значительно меньшей скоростью, чем это соответствует теоретически возможному числу встреч молекул. Например: ![]() при
при ![]() скорость реакции составила бы примерно
скорость реакции составила бы примерно ![]() , если учесть что каждое из столкновений приводит к хим. превращениям. Практически в этих условиях эта реакция протекает со скоростью примерно
, если учесть что каждое из столкновений приводит к хим. превращениям. Практически в этих условиях эта реакция протекает со скоростью примерно ![]() , т е в
, т е в ![]() раз медленнее. Кроме того из молекулярно-кинетической теории газов следует, что число соударений примерно равно корню квадратному из Т, в то время как скорость реакции растет с Т по показанному закону. Известно, что в некоторых случаях реагенты могут находиться в соприкосновении без взаимодействия между ними. Все эти факты объясняет теория активных столкновений Аррениуса. В основе теории лежит представление о том. Что хим. взаимодействие осуществляется лишь при столкновении активных молекул, т е молекул обладающих избытком энергии (энергии активации). Такой хим. процесс по этой теории представляется схемой: Нормальные молекулы
раз медленнее. Кроме того из молекулярно-кинетической теории газов следует, что число соударений примерно равно корню квадратному из Т, в то время как скорость реакции растет с Т по показанному закону. Известно, что в некоторых случаях реагенты могут находиться в соприкосновении без взаимодействия между ними. Все эти факты объясняет теория активных столкновений Аррениуса. В основе теории лежит представление о том. Что хим. взаимодействие осуществляется лишь при столкновении активных молекул, т е молекул обладающих избытком энергии (энергии активации). Такой хим. процесс по этой теории представляется схемой: Нормальные молекулы![]() Активные молекулы
Активные молекулы![]() Продукт реакции. Скорость 1 процесса больше скорости 2, и в системе всегда сохраняется равновесие между нормальными и активными молекулами. Следует, что для сообщения молекулам энергии активации, её нужно подводить извне. Известно, что в системах, состоящих из очень большого числа частиц, энергия распределена между ними не равномерно. Превышающая средняя энергия сообщается некоторой частью молекул, в следствие перераспределения при столкновении. Среди
Продукт реакции. Скорость 1 процесса больше скорости 2, и в системе всегда сохраняется равновесие между нормальными и активными молекулами. Следует, что для сообщения молекулам энергии активации, её нужно подводить извне. Известно, что в системах, состоящих из очень большого числа частиц, энергия распределена между ними не равномерно. Превышающая средняя энергия сообщается некоторой частью молекул, в следствие перераспределения при столкновении. Среди ![]() молекул при определённой температуре встречаются
молекул при определённой температуре встречаются ![]() активных молекул. По Больцману
активных молекул. По Больцману ![]() ,
, ![]() - число молекул, которые имеют избыток энергии. В следствие этого скорость реакции должна быть примерно равна непосредственно концентрации С.
- число молекул, которые имеют избыток энергии. В следствие этого скорость реакции должна быть примерно равна непосредственно концентрации С. ![]() ,
, ![]() . Тогда скорость хим. реакции
. Тогда скорость хим. реакции ![]() можно записать:
можно записать: ![]() ,
, ![]() - коэффициент пропорциональности. Сравнивая эти выражения с выражением для скорости этой реакции по закону действия масс.
- коэффициент пропорциональности. Сравнивая эти выражения с выражением для скорости этой реакции по закону действия масс. ![]() ,
, ![]() . Величина Е складывается из величин
. Величина Е складывается из величин ![]() и
и ![]() , взятых в определённом соотношении. Коэффициент
, взятых в определённом соотношении. Коэффициент ![]() в теории активных соударений принимают равным:
в теории активных соударений принимают равным: ![]() , где
, где ![]() - число столкновений между реагирующими молекулами,
- число столкновений между реагирующими молекулами, ![]() - стерический фактор.
- стерический фактор. ![]() .
.
