Получение акролеина газофазным окислением пропилена кислородом воздуха
![]()
![]()
![]()
![]()
Таким образом в интервале температур от 653 до 693К все три реакции термодинамически возможны.
>1.4 Кинетика процесса окисления пропилена
Процесс окисления пропилена проходит в присутствии катализатора и является гетерогенно-каталитическим. В качестве катализатора используется оксиды переходных металлов CuO + Cu2O, V2O5, в то время как другие оксиды неселективны или способствуют полному окислению. В нашем проекте используется катализатор CuO на силикагеле. Процесс окисления проходит по окислительно-восстановительному механизму. Он состоит в том, что сорбированный на ионе металла углеводород окисляется кислородом, металл при этом восстанавливается в низшее валентное состояние и затем вновь взаимодействует с кислородом, переходит в первоначальную форму:
2Cu2O + CH2 = CH –– CH3 4Cu + CH2 = CH –– CHO + H2O
4Cu + O2 2Cu2O
Этот механизм подтверждается тем, что ожидаемые продукты могут получаться на катализаторе в отсутствие кислорода, а стадии окисления углеводорода и окисления катализатора можно проводить раздельно.
В механизме гетерогенных реакций окисления важную роль играет адсорбция реагентов на поверхности контакта. На металлах кислород сорбируется очень быстро с последующим более медленным проникновением в приповерхностный слой. Кислород сорбируется на контакте без диссоциации или с диссоциацией молекулы. Причём металл поставляет требуемые электроны и переводит адсорбированный кислород в состояние ион-радикала:
+ Me
Me + O2 Me –– O ––![]() 2Me ––
2Me –– ![]()
Углеводороды сорбируются на металлах сравнительно слабо и обратимо. Прочнее они сорбируются на оксидных катализаторах, причём электроны, необходимые для образования связей, поставляются молекулой олефина, которая переходит в состояние хемосорбированного ион-радикала.
Cu++ + CH2 = CH –– CH3 Cu+–– CH2 ––![]() H –– CH3
H –– CH3
Ион металла при этом восстанавливается в одной из низших валентных форм. В результате совместного действия кислорода, ионы металлов часто находятся в разных валентных состояниях. В слое катализатора в зависимости от состава реакционной смеси и условий реакции устанавливается динамическое равновесие:
![]()
![]() Cu Cu2O CuO
Cu Cu2O CuO
Из этих трёх форм оксид меди (I) является специфическим, селективно действующим катализатором окисления пропилена в акролеин. Оксид меди (II) оказывает каталитическое действие на реакцию полного окисления пропилена в СО2, а металлическая медь неактивна.
При избытке кислорода по отношению к пропилену концентрация Cu2O в катализаторе может достигать 70%, что положительно сказывается на выходе акролеина.
1.5 Методы получения акролеина
1) из глицерина
H2SO4, 190°C
![]() СН2(ОН)СН(ОН)СН2ОН CH2 = CHCHO + 2H2O
СН2(ОН)СН(ОН)СН2ОН CH2 = CHCHO + 2H2O
2) из диаллилового эфира
515°С
![]() СН2 = СНСН2 –– О –– СН2СН = СН2 СН2 = СНСНО + СН2 = СНСН3
СН2 = СНСН2 –– О –– СН2СН = СН2 СН2 = СНСНО + СН2 = СНСН3
3) из аллилового спирта
О2, 200°С
СН2 = СНСН2ОН СН2 = СНСНО
4) из тетрагидрофурфурилового спирта
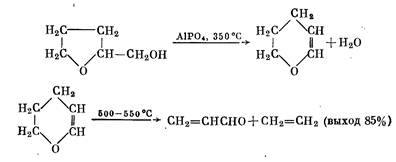
5) из формальдегида и ацетальдегида
300-320 °С, SiO2
![]() НСНО + СН3СНО СН2 = СНСНО + Н2О + 19,5 ккал
НСНО + СН3СНО СН2 = СНСНО + Н2О + 19,5 ккал
6) из пропилена
![]() СН2 = СНСН3 СН2 = СНСНО + Н2О
СН2 = СНСН3 СН2 = СНСНО + Н2О
Применение в промышленности нашли только два последних метода. Однако из-за применения дорогостоящего сырья, серной кислоты и образования сульфата аммония, в настоящее время широко используется только метод прямого окисления пропилена.
2 Обоснование выбора оптимальных условий процесса синтеза
Кинетические уравнения, полученные при исследовании конкурентного химического процесса используют для выбора оптимальных условий его реализации, то есть выбора типа реакторов, температуры, начальных концентраций и мольного соотношения реагентов, степени конверсии и т.д. Обычно руководствуются двумя главными показателями: удельной производительностью реактора и селективностью процесса. Однако ни один из них отдельно не может служить критерием для окончательного выбора одного варианта проведения процесса. Таковыми являются ещё и экономические показатели, а именно минимум себестоимости продукта, максимум прибыли при его производстве или минимум удельных приведенных затрат. Но оптимизация по последним критериям представляет сложную задачу, поэтому определять оптимальный режим синтеза акролеина будем с точки зрения интегральной селективности целевого продукта по исходному ключевому реагенту ![]() и максимальной удельной производитель-ности
и максимальной удельной производитель-ности ![]() . При выборе реактора предпочтения отдаём реактору идеального вытеснения, т.к. он обладает большей производительностью, чем реактор полного смешения. Кроме того в реакторах идеального вытеснения достигается более высокая степень конверсии.
. При выборе реактора предпочтения отдаём реактору идеального вытеснения, т.к. он обладает большей производительностью, чем реактор полного смешения. Кроме того в реакторах идеального вытеснения достигается более высокая степень конверсии.
2.1 Связь селективности с кинетикой
Процесс окисления пропилена в акролеин представляет собой систему параллельных реакций:
СН2 = СН –– СН3 + О2 ![]() СН2 = СН ––СНО + Н2О (1)
СН2 = СН ––СНО + Н2О (1)
А + Y ![]() B + D
B + D
C3H6 + 4,5O2 ![]() 3CO2 + 3H2O (2)
3CO2 + 3H2O (2)
A + Y ![]() C + D
C + D
C3H6 + 3O2 ![]() 3CO + 3H2O (3)
3CO + 3H2O (3)
A + Y ![]() E + D
E + D
Для облегчения расчетов выпишем значения следующих величин: скорости реакций, константы скорости:
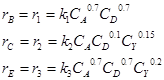
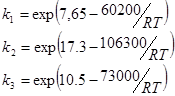
где ![]()
Пропилен образует с воздухом взрывоопасные смеси, поэтому применяют начальную концентрацию пропилена в воздухе меньше нижнего предела взрываемости ![]() =1,9% (мол).
=1,9% (мол).
Дифференциальная селективность для реактора полного смешения
