Исследование методов наблюдения доменов в тонких ферромагнитных пленках
где h – постоянная Планка.
Спин есть неотъемлемое свойство электрона (наравне с зарядом и массой). Благодаря существованию у электрона собственного момента импульса он обладает спиновым магнитным моментом МS. Его проекция на направлении Н равна
(μ![]() ) = - еħ / 2m
) = - еħ / 2m
где |е| = 1,7·10-19 Кл – заряд электрона, m = 9,1·
10-31 кг – масса покоя электрона.
По абсолютной величине эта проекция равна атомной единице магнитного момента – магнитному Бора [1, с. 6-7]
μ![]() = еħ / 2m = 9,27·10-24 А·м2
= еħ / 2m = 9,27·10-24 А·м2
Как показывают расчеты, величина магнитного момента, обусловленного движением электрона по орбите, кратна некоторой величине, носящей название магнетона Бора. Магнетон Бора μ![]() есть наименьшее значение магнитного момента, которое может иметь электрон
есть наименьшее значение магнитного момента, которое может иметь электрон
μ![]() = h/4pc·e/m, (1)
= h/4pc·e/m, (1)
где h – постоянная Планка, равная 6,625·10-27 эрг·сек (или 6,625·10-34 Дж·с);
е – заряд электрона;
m – его масса.
Таким образом, орбитальный магнитный момент электрона равен целому числу магнетонов Бора
μ = n·μ![]() , (2)
, (2)
где n – целое число (1, 2, 3 и т.д.)
Двигаясь по орбите вокруг ядра, электрон обладает также орбитальным механическим моментом Р, кратным h/2p, т.е. орбитальный механический момент Р равен:
Р = n (h/2p), (3)
Таким образом отношение магнитного орбитального момента к механическому орбитальному моменту равно:
μ / P = e / 2mc (4)
Помимо движения вокруг ядра по орбите, электрон вращается еще вокруг собственной оси. Такое вращение приводит также к образованию магнитного момента (рисунок 1).
Этот магнитный момент, вызванный вращением электрона вокруг своей оси, носит название спинового магнитного момента ( от английского to spin – вращаться).
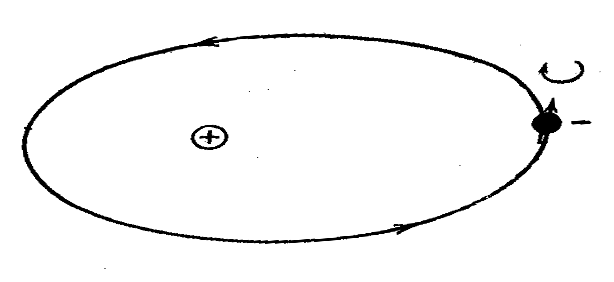
Рисунок 1 - Орбитальный и спиновый моменты электронов.
Величина спинового магнитного момента, или просто спина, равна в точности магнетону Бора, а величина спинового механического момента равна 1/2 h/2p.
Атомы различных веществ имеют разное количество электронов. У изолированного атома в нормальном состоянии число электронов, вращающихся вокруг ядра, равно его порядковому номеру в периодической системе элементов Менделеева. Так, у атома водорода вокруг ядра вращается один электрон, у атома гелия – два, у натрия стоящего в периодической системе под номером 11, вокруг ядра вращаются одиннадцать электронов.
Ядро атома тоже представляет собой сложную систему, состоящую из частиц двух типов: протонов и нейтронов. Протон – положительно заряженная частица с массой, превышающей массу электрона в 1836,5 раз.
Протон, так же как и электрон, обладает некоторым магнитным моментом, т.е. представляет собой маленький магнитик. Магнитный момент протона меньше, чем магнитный момент электрона в 658 раз, а магнитный момент нейтрона – в 960 раз.
Атом в целом представляет сложную магнитную систему. В самом деле, ядро атома состоит из протонов и нейтронов, каждый из которых обладает магнитным моментом, причем эти моменты могут быть ориентированы различно; вокруг ядра атома вращаются электроны, каждый из которых обладает как орбитальным, так и спиновым магнитными моментами. Магнитный момент атома будет суммой этих моментов, причем сумма эта будет не арифметическая, а более сложная, учитывающая не только численные значения магнитных моментов отдельных частиц, но и их направления. Магнитные моменты протонов и нейтронов значительно меньше магнитных моментов электронов, поэтому можно считать, что магнитные свойства атома определяются в основном магнитными свойствами его электронной оболочки.
Так обстоит дело в случае изолированного атома. В случае же твердого тела, представляющего собой коллектив огромного количества атомов, магнитный момент каждого из них определяется не только частицами, принадлежащими данному атому, но и их взаимодействием с частицами соседних атомов.
Из всего этого следует, что атомов, на которых бы не действовало магнитное поле, не существует. Все атомы в той или иной степени подвергаются действию магнитного поля, т.е. все они в той или иной степени магниты. Следовательно, немагнитных веществ также не существует; все тела в той или иной степени магнитны, поскольку магнитны атомы, из которых они состоят.
По магнитным свойствам все тела можно отнести к одному из пяти видов: диамагнетикам, парамагнетикам, ферромагнетикам, антиферромагнетикам и ферримагнетикам [7, с.20-23].
Диамагнитные и парамагнитные вещества относятся к числу слабомагнитных. Ферромагнетики – тела сильно магнитные. Они сильно намагничиваются даже в слабых магнитных полях и их намагниченность можно обнаружить с помощью простых средств [7, с. 30].
Магнетизм сильных магнетиков был обнаружен еще на заре развития физической науки. Однако объяснение сильного магнетизма было сделано гораздо позже, чем слабого. Сначала физики поняли природу диа – и парамагнетизма (правда, чисто квазиклассически) и только значительно позже – ферро – и антиферромагнетизма. Объяснить же эти, казалось, чисто магнитные явления удалось только с помощью квантовой механики, квазиклассические аналоги оказались бессильными [4, с. 60].
1.3 Энергия обменного взаимодействия
Для того, чтобы легче перейти к сложным системам, рассмотрим сначала простой случай двух атомов водорода. Каждый из которых состоит из протона и электрона, которые обладают электрическими зарядами +е и –е и магнитными моментами μ![]() и μ
и μ![]() (здесь мы не будем обращать внимания, что у электрона и особенно у протона фактические магнитные моменты отличаются от магнетонов Бора). Магнитный момент электрона почти в две тысячи раз больше магнитного момента протона. Пока атомы далеки друг от друга, их взаимодействием можно пренебречь. При их сближении кулоновские силы притяжения и отталкивания между электронами и протонами обоих атомов будут расти обратно пропорционально квадрату расстояния. Но кроме квазиклассической части этих взаимодействий возникнут еще специфические квантовые добавки тоже электростатического происхождения, неизвестные в классической физике.
(здесь мы не будем обращать внимания, что у электрона и особенно у протона фактические магнитные моменты отличаются от магнетонов Бора). Магнитный момент электрона почти в две тысячи раз больше магнитного момента протона. Пока атомы далеки друг от друга, их взаимодействием можно пренебречь. При их сближении кулоновские силы притяжения и отталкивания между электронами и протонами обоих атомов будут расти обратно пропорционально квадрату расстояния. Но кроме квазиклассической части этих взаимодействий возникнут еще специфические квантовые добавки тоже электростатического происхождения, неизвестные в классической физике.
Дело в том, что электрон в одном атоме физически полностью тождествен с электроном в другом атоме, т.е. мы имеем дело с системой двух тождественных частиц, которые принципиально нельзя пронумеровать.
Когда атомы настолько сближены, что образуется молекула водорода Н2 (рисунок 2), то электроны как бы обобществляются на молекулярной орбите и проследить за каждым из них индивидуально нельзя. Они непрерывно обмениваются местами около обоих протонов. С этим обменом тождественных электронов и связано добавочное к обычному квазиклассическому кулоновскому взаимодействию электрическое взаимодействие, называемое обменным. По величине оно близко к квазиклассическому электростатическому взаимодействию, т.е. к 10-13 эрг в расчете на один электрон. Вот это взаимодействие и играет первостепенную роль как в формировании ковалентной химической связи двухатомных – более сложных молекул (в которых мы имеем долю не с простой электростатической связью противоположно заряженных ионов), так и в энергии связи в построенных из нейтральных атомов конденсированных телах (жидкостях и кристаллах). Этот же тип взаимодействия определяет также и атомную упорядоченную магнитную структуру в твердых телах.
Другие рефераты на тему «Физика и энергетика»:
Поиск рефератов
Последние рефераты раздела
- Автоматизированные поверочные установки для расходомеров и счетчиков жидкостей
- Энергосберегающая технология применения уранина в котельных
- Проливная установка заводской метрологической лаборатории
- Источники радиации
- Исследование особенностей граничного трения ротационным вискозиметром
- Исследование вольт-фарадных характеристик многослойных структур на кремниевой подложке
- Емкость резкого p-n перехода
