Возможность улучшения качества учебно-воспитательной работы на уроках химии путем экологизации содержания темы "S-элементы"
3SrX2 (р) + Са3(Р04)2 (т) ↔ Sr3(P04)2 (т) + ЗСаХ2 (р)
где X = С1−, НСО3− и др., смещается вправо
Как уже упоминалось, именно в результате замещения ионов кальция в костной ткани на стронций возникает «стронциевый» рахит — повышенная ломкость костей. Образование очень прочного и малорастворимого бария фосфата Ваз(Р04)2 в костной ткани, нервных клетках и мозговом веществ
е обусловливает токсичность иона Ва2+.
Однако следует отметить, что в активации некоторых ферментов ионы бария и стронция являются синергистами кальция.
Многие соли кальция и магния находят применение в медицине. Антацидным и легким слабительным действием обладает магний карбонат основной Mg(OH)2∙4MgC03∙H20 (белая магнезия), механизм действия которого аналогичен магния оксиду MgO.
Магний сульфат (горькая соль) MgS04∙7H2O оказывает при парентеральном введении успокаивающее действие на центральную нервную систему. В зависимости от дозы может наблюдаться седативный, снотворный или наркотический эффект. Действие препарата основано на том, что ионы Mg2+ в зависимости от концентрации блокируют или обеспечивают нервно-мышечную передачу, они понижают возбудимость дыхательного центра, а также угнетают сосудо-двигательный центр, вследствие чего снижают артериальное давление.
MgS04∙7H20 применяют и как слабительное. При пероральном приеме магния сульфата из-за плохой его всасываемости, как и в случае Na2S04∙10H2O, в просвете кишечника создается высокое осмотическое давление, что приводит к диффузии воды в просвет кишечника. В результате этого происходит разжижение и увеличение объема кишечного содержимого, что обусловливает акт дефекации.
В качестве адсорбирующего и обволакивающего средства в медицине широко применяют силикатное производное Mg — тальк 2MgSi03∙Mg(HSi03)2.Это соединение используют также в качестве компонента для приготовления лекарственных форм — паст и таблеток.
Используют кальций хлорид при отравлении солями магния, а также оксалат- и фторид-ионами. Применение препарата в первом случае основано на взаимозамещаемости ионов кальция и магния в организме, а во втором случае — на, образовании нетоксичных малорастворимых соединений кальция оксалата и фторида:
Са2+ (р) + С202- (р) = СаС204 (т)
Са2+ (р) + 2F- (р) = CaF2 (т)
Антацидным и адсорбирующим действием обладает кальций карбонат СаСОз. Его назначают внутрь при повышенной кислотности желудка, так как он нейтрализует соляную кислоту:
СаСОз (т) + 2НС1 (жел. сок) = СаС12 (р) + Н20 (ж) + С02 (г)
Кальций сульфат (жженый гипс) СаSО4∙½Н2О применяют для приготовления гипсовых повязок при переломах, а также в качестве слепочного материала при протезировании зубов. Получают жженый гипс обжигом гипса CaS04∙2H20 при температуре не выше 453 К:
CaS04•2Н20 = CaS04•1/2Н20 + 3/2 Н20
При замешивании жженого гипса в небольшом количестве воды происходит образование гипса. Этот процесс называется схватыванием гипса:
CaS04∙½H20 (т) + 3/2H2O (ж) = CaS04-2H20 (т)
Затвердевание гипсового теста сопровождается некоторым увеличением объема, что способствует получению хороших слепков.
Находит применение в медицине и радиоактивный изотоп 45Са. С помощью этого изотопа были изучены процессы всасывания и распределения кальция в организме, отложения его в костях и выведение при нормальной жизнедеятельности организма и различных патологиях.
Поскольку ионы бария и стронция обладают токсическим действием, их соединения практически не применяются в медицине. Исключение составляет барии сульфат, который не подвергается гидролизу и не растворяется в соляной кислоте желудочного сока, вследствие чего и отсутствует токсическое действие при приеме этого вещества внутрь. Применяют эту соль для рентгеновской диагностики заболеваний пищеварительного тракта в качестве контрастного вещества, так как BaS04 сильно поглощает рентгеновские лучи. Но следует учитывать, что отдельные люди обладают повышенной чувствительностью к этому соединению.
Биологическая роль s-элементов IIА-группы
Их применение в медицине бериллий постоянно находится в растениях, а также в организмах животных. В последние годы появились сообщения, что содержание бериллия в живых организмах составляет ~ 10-7%,т. е. он является примесным ультрамикроэлементбм. Биологическая роль бериллия изучена недостаточно. Известно, что соединения бериллия токсичны и вызывают ряд заболеваний (бериллиевый рахит, бериллиоз и т.д.). Особенно токсичны летучие соединения бериллия. Как уже было рассмотрено выше, отрицательное влияние иона Ве2+ на физиологические процессы можно объяснить его химическими свойствами (способностью образовывать прочные связи с биолигандами и хорошей растворимостью фосфатов бериллия).
Магний формально относится к макроэлементам. Общее содержание его в организме 0,027% (около 20 г). Топография магния в организме человека такова: в наибольшей степени магний концентрируется в дентине и эмали зубов, костной ткани. Накапливается он также в поджелудочной железе, скелетных мышцах, почках, мозге, печени и сердце (рис.). У взрослого человека суточная потребность в магнии составляет около 0,7 г. Ион магния, так же как и ион калия, является внутриклеточным катионом.
В биологических жидкостях и тканях организма магний находится как в виде акваиона, так и в связанном с белками состоянии в количестве < 10, т. е. по сущности это микроэлемент.
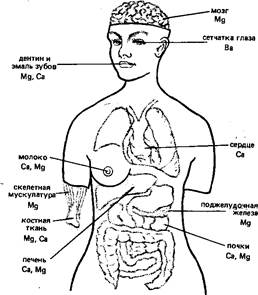
Рис. Топография s-элементов ПА-группы в организме человека
Концентрация ионов магния внутри клеток примерно в 2,5—3 раза выше, чем во внеклеточных жидкостях. Ионы магния играют важную биологическую роль в организме человека. Вследствие меньшего радиуса иона и большей энергии ионизации ион Mg2+ образует более прочные связи, чем ион кальция, и поэтому является более активным катализатором ферментативных процессов. Входя в состав различных ферментативных систем, ион магния является их незаменимым компонентом и активатором (такие ферменты, как карбоксипептидаза, холинэстераза и некоторые другие, являются специфическими для иона магния).
Гидролиз АТФ, сопряженный с рядом ферментативных реакций, в результате которых образуется гидрофосфат-ион НРО2- и выделяется большое количество энергии, проходит при обязательном избытке ионов Mg2+.
Кальций относится к макроэлементам. Общее содержание его в организме 1,4% .Кальций содержится в каждой клетке человеческого организма. Основная масса кальция находится в костной и зубной тканях (см. рис.). В среднем взрослый человек в сутки должен потреблять 1 г кальция, хотя потребность в кальции составляет только 0,5 г. Это связано с тем, что кальций, вводимый с пищей, только на 50% всасывается в кишечнике. Сравнительно плохое всасывание является следствием образования в желудочно-кишечном тракте труднорастворимых кальция фосфата Са3(Р04)2 и кальциевых солей жирных кислот:
Другие рефераты на тему «Педагогика»:
- Педагогическая поддержка адаптации детей 3-4 лет в дошкольном образовательном учреждении
- "Внешкольная" общественная деятельность учительства в социокультурной жизни провинции в СССР
- Знакомство с цифрами дошкольников
- Влияние игры на межличностные отношения младших школьников
- Закономерности и принципы обучения
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
