Возможность улучшения качества учебно-воспитательной работы на уроках химии путем экологизации содержания темы "S-элементы"
Таким образом, из элементов IA-группы физиологически активны Li, Rb, Cs, a Na и К — жизненно необходимы. Близость физико-химических свойств Li и Na, обусловленная сходством электронного строения их атомов, проявляется и в биологическом действии катионов (накопление во внеклеточной жидкости, взаимозамещаемость). Аналогичный характер биологического действия катионов элементов больших периодов — К
+, Rb+, Cs+ (накопление во внутриклеточной жидкости, взаимозамещаемость) также обусловлен сходством их электронного строения и физико-химических свойств. На этом основано применение препаратов натрия и калия при отравлении солями лития и рубидия.
Общая характеристика s-элементов ПА-группы
Щелочно-земельные металлы
| Период | Группа |
| n | IIА |
| 2 | 4Be |
| 3 | 12Mg |
| 4 | 20Ca |
| 5 | 38Sr |
| 6 | 56Ва |
| 7 | 88Ra |
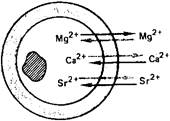
Клетка
Во вторую группу периодической системы входят бериллий, магний и щелочно-земельные металлы — кальций, стронций, барий, радий, имеющие большое значение в жизнедеятельности. Наиболее важными среди этих элементов для живых организмов являются макроэлементы магний и кальций и микроэлементы стронций и барий. Магний входит в состав многих ферментативных систем, а кальций является главным компонентом костной ткани. Стронций оказывает влияние на процессы в костной ткани, а барий, очевидно, играет определенную роль в функционировании органов зрения. Если о биологической роли магния и кальция многое известно, то влияние микроэлементов стронция, бария и радия на живые организмы изучено очень мало. В живых организмах эти элементы находятся в степени окисления + 2.
В табл. 1 и 2 приведены некоторые свойства s-элементов IIА-группы. Атомы этих элементов имеют по два валентных электрона на s-подуровне внешнего энергетического уровня, т. е. электронная формула валентной оболочки s-элементов
Таблица 1
Свойства атомов щелочно-земельных элементов
| Характеристика | 4Ве | 12Mg | 20Са | 38Sr | 26Ва | 88Ra |
|
Валентные электроны | 2s2 | 3s2 | 4s2 | 5s2 | 6s2 | 7s2 |
|
Молярная масса, г/моль | 9,0 | 24,3 | 40,1 | 87,6 | 137,3 | 226 |
|
Металлический радиус атома, пм | 133 | 160 | 197 | 215 | 221 | 235 |
|
Кристаллический радиус иона Э2+, пм | 34 | 74 | 104 | 120 | 138 | 144 |
|
Энергия ионизации; кДж/моль | ||||||
|
Э → Э+ | 899 | 738 | 590 | 549 | 503 | 509 |
|
Э+ → Э2+ | 17 | 1450 | 114 | 106 | 965 | 979 |
Таблица 2
Свойства элементных веществ группы IIА
| Характеристика | Be | Mg | Са | Sr | Ba | Ra |
|
Плотность, г/см3 | 1,85 | 1,74 | 1,54 | 2,63 | 3,76 | 6,00 |
|
Температура плавления, К | 1558 | 924 | 1123 | 1043 | 983 | 1233 |
|
Температура кипения, к | 3243 | 1380 | 1753 | 1653 | 1913 | 1413 |
|
Стандартный электродный потенциал | ||||||
|
(Э2+ + 2e- = Э°), В | -1,85 | —2,36 | —2,87 | —2,89 | —2,91 | —2,92 |
|
Координационное число | 4 | 6 | 6,8 | 6,8 | 6,9 | 6,8 |
Другие рефераты на тему «Педагогика»:
- Планирование и учет в тренировке юных спортсменов в избранном виде спорта
- Методические рекомендации для подготовки учащихся 8 класса к проведению химического эксперимента
- Совершенствование монологической речи на основе аутентичных текстов в 6 классе средней общеобразовательной школе
- Анализ уроков истории студентов-практикантов
- Дидактическая игра в развитии внимания у дошкольников
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
