Физико-химические свойства и методы контроля качества товаров
Иногда при сложном составе пробы не удается разделить ее компоненты с помощью одного растворителя. Тогда применяют двумерную хроматографию. В угол квадратного листа хроматографической бумаги наносят хроматографической бумаги наносят раствор пробы и хроматографируют сначала в одном элюенте, затем, повернув хроматограмму на 90, - в другом. Первый элюент производит предварительное разделение компо
нентов пробы, второй окончательное.
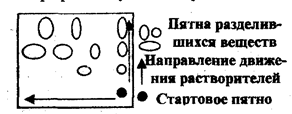
Рис.2.6.2 Двухмерная хроматография
Для проведения хроматографии на бумаге используют стеклянные герметизированные камеры. Внутри камеры в верхней (нисходящий вариант) или нижней ее части (восходящий вариант) помещают сосуд для подвижной фазы (лодочку).
Радиальную хроматографию можно осуществить в чашке Петри. Детекцию зон, идентификацию и количественное определение в БХ проводят также, как и в методе тонкослойной хроматографии.
Методом распределительной жидкостной бумажной хроматографии успешно анализируют смеси катионов в неорганическом качественном анализе, смеси аминокислот и других органических кислот, пептидов, пестицидов, фенолов, красителей, синтетических поверхностно-активных веществ.
2.7 Гельпроникающая (молекулярно-ситовая) хроматография
Гельпроникающая хроматография (ГПХ) представляет собой метод разделения молекул, основанный на различии из размеров.
В качестве НФ в ГПХ используют частицы, имеющие определенные размеры пор. Это различного рода гели (мягкие, полужесткие и жесткие). В качестве ПФ служат водные или органические элюенты. Принцип разделения молекул в ГПХ состоит в том, что молекулы анализируемых веществ распределены между неподвижным растворителем в порах сорбента и растворителем, протекающим через слой НФ. Молекулы, которые имеют размеры, позволяющие им проникать в поры сорбента при движении вдоль колонки, часть времени теряют на пребывание в порах. Молекулы, имеющие размеры, превышающие размеры пор, не проникают в сорбент и вымываются из колонки со скоростью движения элюента. Молекулы, которые проникают в поры всех размеров, движутся наиболее медленно. Снижение скорости движения веществ вдоль колонки тем больше, чем в большее число пор способны диффундировать распределяемые частицы.
Таким образом, при помощи ГПХ можно разделить смеси веществ в зависимости от размеров их молекул. Выход веществ из колонки происходит в порядке уменьшения их молекулярной массы. Так можно разделить полипептиды, белки и другие макромолекулы.
Гельпроникающая хроматография на колонке используется для очистки пестицидов, а также жирорастворимых витаминов перед их определением методом ВЖХ.
Электрофорез
Метод анализа, основанный на способности заряженных частиц к передвижению во внешнем электрическом поле называют электрофорезом (от “электро” и греческого phoresis — перенесение).
Электролиз относится к методам разделения без превращения веществ, на основе заряда частиц. По технике выполнения метод аналогичен хроматографии, поэтому и рассматривается в этой главе.
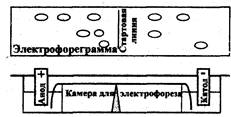
Рис 2.7.1 Схема прибора для электрофореза
Нередко под электрофорезом понимают перемещение коллоидных частиц или макромолекул, в отличие от иовофореза - перемещения неорганических ионов малого размера.
Передвижение частиц при электрофорезе зависит от ряда факторов, основными из которых являются: напряженность электрического поля; величина электрического заряда; скорость и размер частицы; вязкость, рН и температура среды, а также продолжительность электрофореза.
Электрофорез можно проводить как в свободном растворе (фронтальный электрофорез), так и на носителях (зональный электрофорез). Последний вариант предпочтительнее, т.к. носители способствуют стабилизации электрофоретических зон. В качестве носителей используют: фильтровальную бумагу, силикагель, крахмал, оксид алюминия, поливинилхлорид, агаровый и полиакриламидный гели и др.
Электрофоретическое разделение осуществляют на бумаге, в тонком слое сорбента, колонке или в блоке (который часто формируют из суспензии крахмала в подходящем электролите).
Аппаратура для электрофореза выполняется по единой схеме: источник тока, камера для электрофореза, два электрода, соединяющих камеру с источником тока и приспособление для сбора и идентификации разделенных веществ (последний блок в некоторых случаях отсутствует). Для электрофореза используют как готовые наборы аппаратуры (универсальный прибор для иммуноэлектрофореза и электрофореза белков на бумаге и крахмале, набор для электрофореза в полиакриламидном геле венгерской фирмы Реанал), так и наборы, составляемые экспериментатором из отдельных приборов.
На рис. 2.7.1 представлена схема прибора для электрофореза на бумаге. Электрофоретическая камера состоит из двух кювет, в которые помещают графитовые электроды и раствор проводящей жидкости (буферный раствор). Выше кювет находится подставка для носителя бумаги. Смесь веществ, подлежащих разделению, наносят на пропитанную проводящей жидкостью бумагу. Бумагу подсушивают, помещают на подставку, концы погружают в кюветы, затем камеру плотно закрывают крышкой. После пропитывания бумаги проводящей жидкостью подключают электрический ток. По окончании электрофореза бумагу подсушивают. Качественную и количественную оценку осуществляют, применяя методы, используемые в бумажной хроматографии, например, проявление белков с помощью красителей, количественную оценку - методом денситометрии.
Важной областью применения электрофореза является анализ белков сыворотки крови, аминокислот гидролизатов белков, нуклеиновых кислот и т.п. В кислотном буферном растворе аминокислота находится в виде катиона NHз+ COOH, который будет перемещаться к катоду, в то время как в щелочном буфере аминокислота превращается в анион NH2 COO-, и будет двигаться к аноду. В изоэлектрической точке аминокислота находится в растворе в виде биполярного иона NH3+ COO- и не будет передвигаться в электрическом поле.
2.8 Газовая хроматография
В газовой хроматографии (ГХ) в качестве ПФ используют инертный газ (азот, гелий, водород), называемый газом-носителем. Пробу подают в виде паров, неподвижной фазой служит или твердое вещество - сорбент (газо-адсорбционная хроматография) или высококипящая жидкость, нанесенная тонким слоем на твердый носитель (газожидкостная хроматография). Рассмотрим вариант газожидкостной хроматографии (ГЖХ). В качестве носителя используют кизельгур (диатомит) - разновидность гидратированного силикагеля, часто его обрабатывают реагентами, которые переводят группы Si-OH в группы Si-О-Si(CH3)3, что повышает инертность носителя по отношению к растворителям. Таковыми являются, например, носители “хромосорб W” и “газохромQ”. Кроме того, используют стеклянные микрошарики, тефлон и другие материалы.
Неподвижную жидкую фазу наносят на твердый носитель. Эффективность разделения в газожидкостной хроматографии зависит главным образом от правильности выбора жидкой фазы. При этом полезным оказалось старое правило: “подобное растворяется в подобном”. В соответствии с этим правилом для разделения смеси двух веществ выбирают жидкую фазу, близкую по химической природе одному из компонентов. Подготовленный носитель помещают в спиральные колонки, имеющие диаметр 2 - 6 мм и длину до 20 м (набивные колонки). С 1957 года стали применять предложенные Голеем капиллярные колонки, имеющие диаметр 0,2 - 0,3 мм и длину в несколько десятков метров. В случае капиллярных колонок жидкая фаза наносится непосредственно на стенку этого капилляра, которая выполняет роль носителя. Применение капиллярных колонок способствует повышению чувствительности и эффективности разделения многокомпонентных смесей.
Другие рефераты на тему «Кулинария и продукты питания»:
Поиск рефератов
Последние рефераты раздела
- Технология приготовления блюд из творога
- Анализ ассортимента и товароведная характеристика пюреобразных плодоовощных консервов для детского питания
- Австралийская кухня
- Биологическая роль углеводов
- Белорусская кухня
- Беларусская национальная кухня
- Анализ эффективности организации и планирования колбасного производства
