Катализаторы в нефтепереработке
Молибденовые катализаторы, особенно переведенные в сульфидную форму, весьма активны в реакциях гидрирования, протекающих в результате разрыва связей С—S. То же действие оказывает, например, молибден с кобальтом на окиси алюминия; очень важно, что катализатор обладает высокой теплостойкостью это способствует удлинению срока его службы, С другой стороны, активность катализатора гидрокрекинга в от
ношении разрыва-связей С—С мала, вследствие чего образование низкскипящих продуктов при условиях, требуемых для удаления серы, незначительно.
Катализаторы гидрогенизационных процессов весьма разнообразны, но их можно классифицировать по назначению так: катализаторы гидроочистки нефтяных дистиллятов; катализаторы гидрокрекинга нефтяного сырья от нефти до мазута; катализаторы деалкилирования.
2.2 Задачи катализаторов
В целом же роль и задача катализаторов - повышать селективность протекающих химических реакций, увеличивая выход целевого продукта из единицы сырья.
3. Основы синтеза катализаторов
Катализатор представляет собой обычно весьма сложные агрегаты отдельных кристаллов.
Первоначальный комплекс, образующий при последующей обработке скелет, содержащий активный компонент, должен удовлетворять следующим требованиям: 1) хорошему развитию поверхности на единицу веса и объема, 2) термической стойкости, 3) широкой возможности вариаций состава.
Этим требованиям удовлетворяет группа веществ, называемых в патентной литературе базообменивателями и представляющих собой соли сложных гетерополикислот. Наибольшее распространение получили комплексы, содержащие кремниевую кислоту, называемые цеолитами.
Оптимальный химический состав и образование каталитически активных соединений являются необходимыми, но все же недостаточными условиями для реализации высокой каталитической активности. Кроме того, необходимо создание довольно развитой внутренней поверхности в твердом катализаторе, а также определенной пористой структуры, которая делает поверхность более доступной для реагентов. Такая структура должна обладать достаточной механической прочностью и стабильностью в условиях проведения каталитических процессов в реакторе. Помощь теории в решении проблемы приготовления катализаторов заключается прежде всего в определении оптимальной пористой структуры.
Основным фактором, определяющим каталитические свойства, несомненно, является химический состав. Однако и при сохранении одинаковым химического состава каталитические характеристики в зависимости от способа и условий приготовления могут изменяться в весьма широких пределах, вследствие изменения природы взаимодействия составных частей катализатора, дисперсности, пористой структуры, кристаллохимических изменений и других факторов, существенно влияющих на протекание каталитических реакций.
Оценка каталитических свойств катализатора в отношении определенной реакции характеризуется следующими показателями:
1. Каталитическая активность, определяемая количеством вещества, реагирующим в единице объема катализатора в единицу времени в заданных условиях.
2. Селективность, характеризуемая отношением скорости образования требуемого продукта к общей скорости превращения исходного вещества при определенном составе реакционной смеси и температуре.
3. Устойчивость (термическая, к действию ядов, к длительности работы).
4. Механическая прочность.
5. Гидродинамические характеристики, определяемые размером, формой и плотностью зерен катализатора.
Задача теории приготовления катализаторов заключается в том, чтобы выявить:
1) от каких свойств катализатора, кроме химического состава, зависят эти основные характеристики;
2) каковы оптимальные значения этих свойств или, точнее, оптимальное сочетание значений этих свойств, определяющее высокое качество катализатора для заданной реакции;
3) какими средствами в процессе приготовления катализаторов можно варьировать эти свойства для достижения их оптимальных значений.
В результате многочисленных исследований процесса синтеза катализаторов гидрогенизационных процессов была предложена наиболее оптимальная схема синтеза:
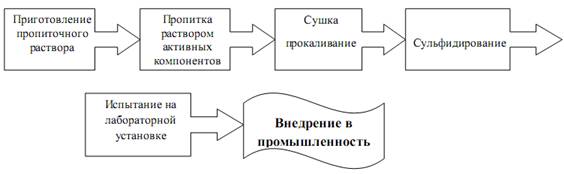
4. Экспериментальная часть
Синтез алюмоникельмолибденового (АНМ) и алюмокобальтмолибденового (АКМ) катализатора гидроочистки проводился согласно выше представленной схеме.
1. Для приготовления нужного катализатора в качестве носителя был выбран Al(OH)3 . В зависимости от условий получения носитель имеет разные свойства. Для нашего эксперимента взяли 250 г гидроксида алюминия. Для начала необходимо провести пептизацию сильной одноосновной кислотой. Взяли 1,5 мл азотной кислоты HNO3, предварительно сделав расчеты (на 100 г Al(OH)3 нужно 0,6 мл кислоты). После внесения кислоты образуются так называемые мицеллы (сгустки Al(OH)3 , окруженные ионами кислоты) и вода. В результате чего снижается вязкость всей массы. Теперь можно проводить модифицирование пористой структуры. В качестве модификатора был выбран триэтиленгликоль (HО-CH2-CH2-O-CH2-CH2-O-CH2-CH2-OH), объемом 62,5 мл (из расчета 25 мл на 100г). Содержимое тщательно перемешивается до однородной белой массы.
2. Затем производится упаривание полученного вещества на «паровой бане» до консистенции пластилина.
3. Следующий этап работы – формование носителя (экструзия). Упаренную массу продавливали через фильеры для придания в данном случае цилиндрической формы (диаметр цилиндра 4 мм).
4. Затем экструдаты сушили на воздухе, потом при температурах 60, 80. 110 оС по 2 часа, затем прокаливали при 550 оС 2 часа (скорость нагрева 1оС/мин)
5. Предварительно сделав расчеты, приготовили пропиточный раствор. Для эксперимента нужно было получить алюмомолибденовые катализаторы с Ni и Со. Опишем ход работы синтезе АКМ катализатора Со(NO3)2 * 6 Н2О. Взяли 5 г парамолибдатаммония (NH4)6Mo7O24*4H2O (ПМА) и растворили в 15 мл дистиллированной воды, в результате чего в склянке образовался бесцветный раствор. Затем взяли 4г нитрата кобальта Со(NO3)2 * 6 Н2О и добавили в раствор 6 мл перекиси водорода H2O2. Затем нагревают и после реакции получают раствор красноватого оттенка ( в склянке с Ni она была зеленого цвета). Приготовили совместный раствор соединений Со и Мо.
6. Следующим шагом было пропитывание носителя получившимся раствором. Данным раствором мы залили 20 г просушенного и прокаленного носителя (п.1-4) и выпаривали на паровой бане.
7. Пропитанный катализатор необходимо высушить по 2 ч при температуре 60, 80, 110 и прокалить в течение 2 часов при 400 оС.
8. Получившийся катализатор мы разделили на 2 образца (по 10 г каждый), один из которых просульфидировали смесью гексана C6H14 и ди-трет-бутилполисульфида (трет-С4Н9)2(S)n ( 11 мл), а затем отправили в муфельную печь на 20 мин, другой же просульфидировали в отдельном реакторе в течение 6 ч.
9. Испытание на лабораторной установке проводится в течение 10 часов.
Заключение
Значение химических каталитических процессов в переработке нефти и газа велико. Большинство из них протекают при участии твердых катализаторов, обеспечивающих более быстрый путь для реакции и способствующих увеличению выхода целевого продукта из единицы сырья. Наиболее крупнотоннажным каталитическим процессом в нефтепереработке является гидроочистка.
Другие рефераты на тему «Химия»:
- Теория МО ЛКАО
- Исследование свойств полимерметаллических комплексов на основе гидрогеля полиакриламид - акриловая кислота - полиэтиленимин без иммобилизованного металла и с ионами Ni2+
- Использование отходов сельскохозяйственного производства
- Частицы и коллектив. Неразличимость и симметрия Коррекция статистических сумм для трансляции и ротации
- Исследование структуры и физико-механических свойств композиций на основе полиэтилена и пространственно сшитого полистирола
