Роль свободных радикалов в природной среде
У/в в атмосфере окисляются активными компонентами – атомарным О, О3 и гидроксильным радикалом, который играет исключительно важную роль в химических превращениях загрязняющих веществ в тропосфере.
Окисление у/в протекает по радикальному механизму через образование на одной из стадий пероксидного радикала ![]() способного окислять NO:
способного окислять NO:
![]() (алкоксильный радикал)
(алкоксильный радикал)
Эта реакция ускоряет образование NO2 и включение его в фотолитический цикл. При этом скорость данной реакции значительно больше, чем скорость реакции, в которой расходуется окислитель озон (![]() )
)
Это и приводит к накоплению озона.
Окислители у/в – атомарный О и О3 образуются в рассмотренном фотолитическом цикле NO2 . Атомарный О в основном участвует в образовании озона, но частично может расходоваться на реакции с у/в
Гидроксильный радикал образуется:
1) главным образом по реакции с Н2О атомарного О(1Д), выделяющегося при фотолизе озона (в основном эта реакция идет в верхних слоях тропосферы, куда проникает излучение с λ<300 нм)
![]()
2) дополнительное количество ОН радикала в тропосфере дает реакция О3 с НО2, который образуется по нескольким реакциям (о них ниже)
![]()
3) и кроме того ОН радикалы, хотя и начинают процесс окисления у/в, т.е. в начале расходуются, но в этих же процессах и накапливаются в условиях загрязненной антропогенными выбросами атмосферы
ОН-радикал наиболее важный окислитель в тропосфере, он начинает большинство многостадийных процессов окисления у/в и других примесей.
Окисление метана и его гомологов
Окисление метана инициируется ОН-радикалом. В последующем в процесс включается молекулярный О2. Сопряжено с окислением СН4 идет окисление NO (т.е. NO включается в цепочку реакций на одной из стадий)
Начальная стадия
![]()
Взаимодействие алкильного (метильного) радикала с О2 дает пероксильный радикал:
![]() ,
,
который как отмечалось определяет альтернативный механизм окисления NO в NO2 (вместо окислителя О3)
Т.е.
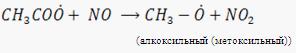
Взаимодействие радикала ![]() с О2 приводит к образованию формальдегида и гидропероксидного радикала
с О2 приводит к образованию формальдегида и гидропероксидного радикала
![]()
Образующийся NO2 включается в фотолитический цикл
![]()
![]()
Что приводит к образованию озона
Гидропероксидный радикал окисляет NO ( как и ![]() )
)
![]() ,
,
генерируя ОН радикал
Таким образом процесс окисления СН4 (и углеводородов вообще) – совокупность реакций, инициируемых солнечным излучение с λ=300-400 нм (которые приводят к О, ОН, НО2), протекающий при участии NO и приводящий к накоплению окислителей О3,ОН
Окисление у/в в этом процесс сопровождается также вторичным загрязнением атмосферы оксидом углерода, которые образуется при превращении СН2О (что по масштабности сопоставимо с выбросами СО при сжигании топлива)
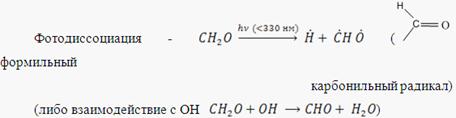
Окисление
![]()
НО2 также дает другая реакции
![]()
Формальную схему суммарной реакции окисления СН4 можно записать в виде
![]()
Таким образом в воздухе накапливается озон и гидроксорадикал, Причем скорость образования О3 зависит от содержания в атмосфере NO – она тем больше чем выше концентрация NO
Озон в тропосфере уже выполняет не защитную функцию как в стратосфере, а губительную вследствие сильных губительных свойств.
По подобной схеме окисляются и другие у/в алканового ряда. При этом скорость взаимодействия у/в с ОН радикалом сильно зависит от строения молекулы алкана (от стабильности образующегося у/в радикала) Очевидно скорость (как стабильность R•) возрастает с увеличением длины цепи и разветвленности алкана, Поэтому например скорость взаимодействия бутана с ОН радикалом на 3 порядка выше,чем с СН4 (к скорости соответственно 2,6·10-12 и 8·10-15).
При окислительных превращениях гомологов метана возможен еще один очень важный путь развития процесса, связанный с реакцией карбонильного радикала с О2
В случае с метаном простейший карбонильный радикал - ![]() , образовавшийся из формальдегида, приводит к СО (по рассматриваемым реакциям)
, образовавшийся из формальдегида, приводит к СО (по рассматриваемым реакциям)
В случае с другими углеводородами карбонильный радикал (со структурой, определяемой структурой исходного углеводорода) присоединяет О2
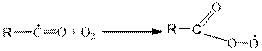
Давая ацилпероксидный радикал, который в конечном итоге приводит к образованию важнейших (с точки зрения воздействия на ОС) продуктов веществ группы ПАН – пероксиацилнитратов.
ПАН- вещества общей формулы 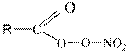 (R – углеводородный радикал) являются наиболее опасными компонентами фотохимического смога. Из них наиболее известен пероксиацетил нитрат, т.е.
(R – углеводородный радикал) являются наиболее опасными компонентами фотохимического смога. Из них наиболее известен пероксиацетил нитрат, т.е. ![]()
Таким образом фотохимические и окислительные превращения углеводородов с участие NОx являются главной причиной образования фотохимического смога – смеси газообразных веществ в сильными окислительными свойствами.
Образование фотохимического смога – обычное явление для крупных городов в большим количество автотранспорта. Выхлопные газы ДВС содержат в сове составе NОx и у/в, которые распространяются в фактически в зоне дыхания.
Обобщим все что говорилось об окислении у/в в единую схему, которой принято описывать образование фотохимического смога
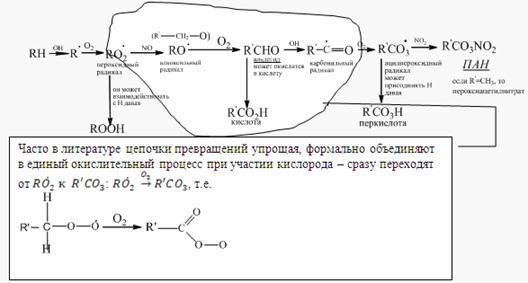
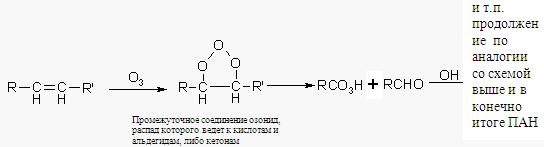
Реакционноспособоные у/в (с двойными связями) также легко окисляются озоном, образуя при это альдегид (либо кетон – в зависимости от строения алкена) и кислоту – продукт последующего окисления по общей схеме:
Значительную долю у/в в атмосфере составляют ароматические у/в (в городах 30-40% от всех органических соединений). Они окисляются гидроскорадикалом по различны механизмам. Основным направление окисление является раскрытие цикла
C образованием перокидного радикала, который окисляется О2 с участием NO через ряд промежуточных стадий, включающих внутримолекулярную циклизацию пероксидного радикала) с раскрытием цикла с образованием дикарбонильных соединений.
Другие рефераты на тему «Химия»:
- Каучуки и кремний органические соединения
- Краткая классификация специальных методов ректификационного разделения
- Аэробное окисление углеводов. Биологическое окисление и восстановление
- Влияние дисперсности алюминия и каталитических добавок на характеристики горения систем на основе активного горючего-связующего
- Производство этилового спирта
