Методика решения задач по теоретическим основам химической технологии
Более высокое отрицательное значение ΔG273 по сравнению с ΔG0298 свидетельствует о том, что при 273 К равновесие еще больше смещено в сторону прямой реакции.
При 100ºС (373 К)
ΔrG373 = -57940 Дж + 373К*164 Дж/К = 3232 Дж/моль.
Положительная величина ΔG373 указывает на изменение направления реакции: равновесие смещено влево, т.е. в сторону распада димера N2O4
(реакция невозможна). Ответ: при 0ºС (273 К) ΔrG273= -13168 Дж/моль, реакция протекает самопроизвольно; при 100ºС (373 К) ΔrG373= 3232 Дж/моль, реакция невозможна.
3. Составьте термохимическое уравнение горения метана СН4 и рассчитайте объем воздуха, необходимый для сжигания 1моль метана, если известно, что при сгорании 5,6 л метана выделяется 220 кДж теплоты, содержание кислорода в воздухе равно 20%.
Решение:
СН4 + 2О2 = СО2 + 2Н2О, ∆Н<0
Находим количество вещества метана объемом 5,6 л
![]()
Если при сгорании СН4 количеством вещества 0,25 моль выделяется 220 кДж теплоты, то при сгорании СН4 количеством вещества 1 моль выделяется 880 кДж теплоты.
Термохимическое уравнение:
СН4 +2О2 = СО2+ 2Н2О+ 880 кДж
Из уравнения реакции видно, что на сгорание СН4 количеством вещества 1моль расходуется О2 количеством вещества 2 моль, на сгорание СН4 количеством вещества 0,25 моль расходуется х моль О2, откуда х = 0,5 моль.
Кислород количеством вещества 0,5 моль занимает объем 11,2 л.
В воздухе 20% кислорода, следовательно, объем воздуха будет равен
![]()
Ответ: 880 кДж, 56 л.
Задачи для самостоятельного решения
1. Рассчитайте, какая из ниже перечисленных реакций при стандартных условиях может идти самопроизвольно:
а) Fe(к) + Al2O3(к) = Al(к) + Fe2O3(к)
б) Al(к) + Fe2O3 (к)= Fe(к) + Al2O3(к)
в) CuSO4(к) + 2NH4OH(ж) = Cu(OH)2(к) + (NH4)2SO4(к)
г) Al2O3(корунд) + 3SO3 = Al2(SO4)2(к)
2. При сварке трамвайных рельсов используют термитную смесь, которую готовят, смешивая порошки алюминия и оксида железа (III) в количественном отношении 2:1. Термохимическое уравнение горения термитной смеси следующее: 2Al + Fe2O3= Al2O3 + 2Fe + 829,62 кДж. Сколько теплоты выделится при образовании: 1) 4 моль железа; 2) 1 моль железа?
3. Рассчитайте, достаточно ли теплоты, выделяющейся при сгорании 200 кг каменного угля, содержащего 82% углерода, для полного разложения 162 кг карбоната кальция, если для разложения 1 моль СаСО3 необходимо 180 кДж теплоты, а при сгорании 1 моль углерода, входящего в состав каменного угля, выделяется 402 кДж теплоты.
4. Процесс алюминотермии выражается химическим уравнением
8Al + 3 Fe3O4 = 4Al2O3 + 9Fe ΔH<0. Рассчитайте, сколько теплоты выделится при сгорании 1 кг термита.
5. Возможен ли обжиг колчедана массой 1т по следующему уравнению химической реакции 4FeS2 + 11O2 →2 Fe2O3 + 8SO2 ∆H<0
6. Вычислите тепловой эффект образования NH3 из простых веществ, при стандартном условии по тепловым эффектам реакции:
2H2 + O2 = 2H2O(ж) ΔН01 = -571, 68 кДж,
NH3 + 3O2 = 6H2O(ж) + 2N2 ΔН02 = -1530,28 кДж.
7. Стандартный тепловой эффект реакции сгорания этана равен -1560 кДж. Рассчитайте стандартную теплоту образования этана, если известно, что
ΔfН0298 (H2O)= -285,84 кДж/моль и ΔfН0298(СО2) = -396,3 кДж/моль.
8. Вычислите тепловой эффект реакции восстановления оксида железа водородом, пользуясь следующими данными.
FeO + CO = Fe + CO2 ΔН = -13,19 кДж
CO + 1/2O2 = CO2 ΔН = -283,2 кДж
2H2 + 1/2O2 = 2H2O(г) ΔН = -242 кДж
9. Протекание, какой из приведенных реакций восстановления оксида железа (III) наиболее вероятно при 298 К.
Fe2O3(k) + 3H2(г) = 2Fe(к) + 3H2O(к)
Fe2O3(k) + 3С(графит) = 2Fe(к) + 3СO(к)
Fe2O3(k) + 3СО(г) = 2Fe(к) + 3СО2(к)
10. В какой их перечисленных ниже реакций тепловой эффект ΔН0298 будет стандартной теплотой SO3(г)
а) S(г) + 3/2 O2 = SO3(г)
а) S(г) + 1/2 O2 = SO3(г)
а) S(к) + 3/2 O2 = SO3(г)
3.1.2 Химическое равновесие
При протекании химической реакции через некоторое время устанавливается равновесное состояние (химическое равновесие). Слово «равновесие» означает состояние, в котором сбалансированы все противоположно направленные на систему воздействия. Тело, находящееся в состоянии устойчивого равновесия, обнаруживает способность возвращаться в это состояние после какого-либо возмущающего воздействия.
Примером тела, находящегося в состоянии устойчивого равновесия, может служить шарик, лежащий на дне ямки. Если его толкнуть в одну или другую сторону, он вскоре снова возвращается в состояние устойчивого равновесия. В отличие от этого шарик, лежащий на краю ямки, находится в состоянии неустойчивого равновесия — достаточно ничтожного толчка, чтобы он необратимо скатился в ямку.
Оба этих примера являются примерами статического равновесия. В химии, однако, приходится сталкиваться не столько со статическими равновесиями, столько с динамическими («подвижными»). Динамическое равновесие устанавливается, когда оказываются сбалансированными два обратимых или противоположных процесса. Динамические равновесия подразделяют на физические и химические. Наиболее важными типами физических равновесий являются фазовые равновесия. Система находится в состоянии химического равновесия, если скорость прямой реакции равна скорости обратной реакции.
Например, если скорость протекания реакции (константа скорости к1)
k1
А(г) + В(пар) ![]() АВ(г)
АВ(г)
равна скорости обратной реакции (константа скорости k2)
k2
АВ(г)![]() А(г) + В(пар)
А(г) + В(пар)
то система находится в динамическом равновесии. Подобные реакции называются обратимыми, а их уравнения записывают с помощью двойной стрелки:
k1
А(г) + В(пар) ![]() АВ(г)
АВ(г)
k2
Реакции, протекающие слева направо, называются прямой, справа налево – обратной.
Нужно подчеркнуть, что реакционная система остается в состоянии динамического равновесия лишь до тех пор, пока система остается изолированной. Изолированной называют такую систему, которая не обменивается с окружающей средой ни веществом, ни энергией.
Состояние химического равновесия обратимых процессов количественно характеризуется константой равновесия. Так, для обратимой реакции общего вида
k1
аA +bB ![]() сC + dD (1.2.1)
сC + dD (1.2.1)
k2
константа равновесия К, представляющая собой отношение констант скорости прямой и обратной реакций, запишется
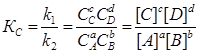 (1.2.2)
(1.2.2)
где, Кс – константа скорости реакции, зависящая от концентрации реагирующих компонентов; Сi или [ i ]- равновесная молярная концентрация i-того компонента;
