Органическая химия
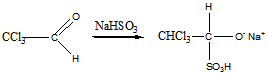
Реакция с гидроксиламином
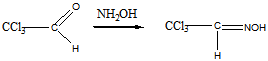
б). реакция с водой
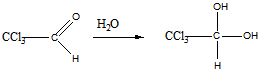
в). щелочное расщепление

4 Оптически активный спирт С5Н12O при дегидратации превращается в соединение, озонолиз которого дает ацетон и уксусный альдегид. Установите строение исходного спирта. Какова конфигурация спирта, если он с уксусной кислотой в присутствии минеральной кислоты образует сложный эфир с d- конфигурацией
Решение
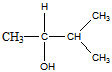
При этерификации конфигурация асимметричного атома углерода не изменяется, так что исходный спирт D-ориентирован.
5.1 Аминокислоты, полипептиды, белки
Аминокислоты - класс азотсодержащих органических кислот, имеющих общие черты строения, которые могут быть представлены общей формулой
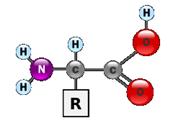
Аминокислоты отличаются друг от друга типом аминокислотного остатка R. Таким образом молекула каждой аминокислоты содержит специфическую часть (боковую группу - R) и неспецифическую часть. Существует около 20 различных аминокислот. Аминокислоты являются строительными блоками (мономерами), из которых строятся все белковые молекулы (полимеры). Основные 20 аминокислот : аланин (ала, ala, A) аргинин (арг, arg, R), aспарагин (асн, asn, N), аспартат (асп, asp, D), валин (вал, val, V), гистидин (гис, his, H), глицин (гли, gly, G), глутамат (глу, glu, E),. глутамин (глн, gln, Q) изолейцин , (илей,ile, I), лейцин , (лей, leu, L), лизин , (лиз, lys, K), метионин , (мет, met, M), пролин , (про, pro, P), серин (сер, ser, S), тирозин , (тир, tyr, Y), треонин , (тре, thr, T), триптофан (три, trp, W), фенилаланин (фен, phe, F), цистеин (цис, cys, C). Свободные аминокислоты составляют примерно 0.5% от веса клетки , входящие в состав белков - около 15%
Аминокислоты - структурные элементы, из которых построены белки. Представляют собою карбоновые кислоты, содержащие одну или две аминогруппы. Общим признаком аминокислот, входящих в состав белка (исключение составляет пролин), является наличие свободной карбоксильной группы и свободной незамещенной аминогруппы у альфа-углеродного атома.Наиболее рациональная классификация аминокислот основана на различиях в полярности R-групп. R-группы подразделяются на четыре основных класса:
1) неполярные, или гидрофобные ;
2) полярные, но незаряженные ;
3) положительно заряженные ;
4) отрицательно заряженные (при pH 6-7) .
Полипептиды. или просто пептиды, природные или синтетич. соед., молекулы к-рых построены из остатков a-аминокислот, соединенных между собой пептидными (амидными) связями C(O) NH. Могут содержать в молекуле также неаминокислотную компоненту (напр., остаток углевода). По числу аминокислотных остатков, входящих в молекулы пептидов, различают ди-пептиды, трипептиды, тетрапептиды и т.д. Пептиды, содержащие до 10 аминокислотных остатков, наз. олигопептидами, содержащие более 10 аминокислотных остатков полипептидами Природные полипептиды с мол. массой более 6 тыс. называются белками.
Белки́ (протеи́ны, полипепти́ды) — высокомолекулярные органические вещества, состоящие из соединённых в цепочку пептидной связью аминокислот. В живых организмах аминокислотный состав белков определяется генетическим кодом, при синтезе в большинстве случаев используется 20 стандартных аминокислот. Множество их комбинаций дают большое разнообразие свойств молекул белков. Кроме того, аминокислоты в составе белка часто подвергаются посттрансляционным модификациям, которые могут возникать и до того, как белок начинает выполнять свою функцию, и во время его «работы» в клетке. Часто в живых организмах несколько молекул белков образуют сложные комплексы, например, фотосинтетический комплекс.
Кроме последовательности аминокислот полипептида (первичной структуры), крайне важна трёхмерная структура белка, которая формируется в процессе фолдинга (от англ. folding, «сворачивание»). Трёхмерная структура формируется в результате взаимодействия структур более низких уровней. Выделяют четыре уровня структуры белка[15]:
Первичная структура — последовательность аминокислот в полипептидной цепи. Важными особенностями первичной структуры являются консервативные мотивы — сочетания аминокислот, важных для функции белка. Консервативные мотивы сохраняются в процессе эволюции видов, по ним часто удаётся предсказать функцию неизвестного белка.
Вторичная структура — локальное упорядочивание фрагмента полипептидной цепи, стабилизированное водородными связями и гидрофобными взаимодействиями. Ниже приведены некоторые распространённые типы вторичной структуры белков:
α-спирали — плотные витки вокруг длинной оси молекулы, один виток составляют 3,6 аминокислотных остатка, и шаг спирали составляет 0,54 нм[16] (так что на один аминокислотный остаток приходится 0,15 нм), спираль стабилизирована водородными связями между H и O пептидных групп, отстоящих друг от друга на 4 звена. Спираль построена исключительно из одного типа стереоизомеров аминокислот (L). Хотя она может быть как левозакрученной, так и правозакрученной, в белках преобладает правозакрученная. Спираль нарушают электростатические взаимодействия глутаминовой кислоты, лизина, аргинина. Расположенные близко друг к другу остатки аспарагина, серина, треонина и лейцина могут стерически мешать образованию спирали, остатки пролина вызывает изгиб цепи и также нарушает α-спирали.
β-листы (складчатые слои) — несколько зигзагообразных полипептидных цепей, в которых водородные связи образуются между относительно удалёнными друг от друга (0,347 нм на аминокислотный остаток[16]) в первичной структуре аминокислотами или разными цепями белка, а не близко расположенными, как имеет место в α-спирали. Эти цепи обычно направлены N-концами в противоположные стороны (антипараллельная ориентация). Для образования β-листов важны небольшие размеры боковых групп аминокислот, преобладают обычно глицин и аланин.
π-спирали;
310-спирали;
неупорядоченные фрагменты.
Третичная или трёхмерная структура — пространственное строение полипептидной цепи (набор пространственных координат составляющих белок атомов). Структурно состоит из элементов вторичной структуры, стабилизированных различными типами взаимодействий. В стабилизации третичной структуры принимают участие:
ковалентные связи (между двумя остатками цистеина — дисульфидные мостики);
ионные связи между противоположно заряженными боковыми группами аминокислотных остатков;
водородные связи;
гидрофильно-гидрофобные взаимодействия.
При взаимодействии с окружающими молекулами воды белковая молекула «стремится» свернуться так, чтобы неполярные боковые группы аминокислот оказались изолированы от водного раствора; на поверхности молекулы оказываются полярные гидрофильные боковые группы.
