Растворение твердых веществ
![]() (1)
(1)
Диффузионный поток к поверхности можно определить с помощью коэффициента массоотдачи ![]() :
:
![]() (2)
(2)
где ![]() - концентрация реагента
- концентрация реагента
в объеме.
В стационарном состоянии количество вещества, вступающее в реакцию на поверхности, равно диффузионному потоку:
![]() (3)
(3)
Уравнение (3) является общим уравнением диффузионно-кинетического режима. При ![]() , т.е. когда реакция имеет первый порядок, получаем:
, т.е. когда реакция имеет первый порядок, получаем:
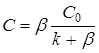 (4)
(4)
Для квазистационарной скорости реакции получим при ![]() :
:
![]() (5)
(5)
где 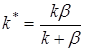 . (6)
. (6)
Это соотношение принимает особенно наглядный вид, если вместо константы скорости реакции и коэффициента массоотдачи рассматривать обратные им величины:
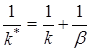 (7)
(7)
Таким образом, полное сопротивление диффузионно-кинетического процесса равно сумме кинетического и диффузионного сопротивлений.
В случае обратимой реакции у поверхности устанавливается концентрация, соответствующая термодинамическому равновесию. Поэтому для простых реакций растворения, сводящихся лишь к образованию на поверхности сольватов и отводу их в раствор, предельный диффузионный поток определяется выражением:
![]()
где ![]() - концентрация насыщенного раствора,
- концентрация насыщенного раствора,
![]() - концентрация растворяемого компонента в объеме.
- концентрация растворяемого компонента в объеме.
Следовательно, в диффузионной области роль константы скорости реакции играет коэффициент массоотдачи ![]() , и наблюдаемая скорость процесса не имеет ничего общего с истинной кинетикой химической реакции.
, и наблюдаемая скорость процесса не имеет ничего общего с истинной кинетикой химической реакции.
Коэффициент массоотдачи ![]() зависит не только от физических свойств раствора, но и от гидродинамических условий взаимодействия частицы с окружающей её сплошной средой. К сожалению, даже в тех случаях, когда межфазовая поверхность может приблизительно рассматриваться как равнодоступная, количественная оценка с помощью уравнений (3) и (4) не может быть дана. Во - первых, мы не располагаем надежными данными для того, чтобы судить об интенсивности конвективной диффузии к частицам, взвешенным в растворе с помощью перемешивающего устройства. Во – вторых, межфазная поверхность совокупности растворяющихся полидисперсных частиц произвольной формы может быть оценена весьма приблизительно, особенно при степени растворения выше 10-20%. Кроме того, в процессе растворения удельная внешняя поверхность также является переменной величиной: функционально уменьшается во времени в зависимости от геометрического размера (диаметра) растворяющихся частиц.
зависит не только от физических свойств раствора, но и от гидродинамических условий взаимодействия частицы с окружающей её сплошной средой. К сожалению, даже в тех случаях, когда межфазовая поверхность может приблизительно рассматриваться как равнодоступная, количественная оценка с помощью уравнений (3) и (4) не может быть дана. Во - первых, мы не располагаем надежными данными для того, чтобы судить об интенсивности конвективной диффузии к частицам, взвешенным в растворе с помощью перемешивающего устройства. Во – вторых, межфазная поверхность совокупности растворяющихся полидисперсных частиц произвольной формы может быть оценена весьма приблизительно, особенно при степени растворения выше 10-20%. Кроме того, в процессе растворения удельная внешняя поверхность также является переменной величиной: функционально уменьшается во времени в зависимости от геометрического размера (диаметра) растворяющихся частиц.
К реакциям, происходящим в пористом материале выводы, полученные для равнодоступной поверхности, совершенно неприменимы.
Рассмотрение диффузионной кинетики дано в работах Я.Б. Зельдовича.
Для стационарного процесса макроскопическая скорость реакции определяется уравнением:
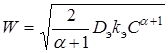 (8)
(8)
С точностью до безразмерного множителя порядка единицы глубину проникновения реакции L можно определить так:
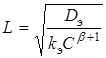 (9)
(9)
Для квазистационарного процесса диффузионный поток равен наблюдаемой скорости реакции. Поэтому:
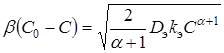 , (10)
, (10)
где ![]() - диффузионный поток активного реагента из объема жидкой фазы к поверхности твердого вещества.
- диффузионный поток активного реагента из объема жидкой фазы к поверхности твердого вещества.
Решая уравнение (10) относительно С и подставляя полученное значение в (8) при ![]() , получим:
, получим:
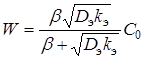 (11)
(11)
При растворении пористого материала или в случае, когда один из компонентов твердого тела не растворяется, а второй - растворяется возможны четыре предельные области:
1. При ![]() скорость суммарного процесса определяется диффузией в объеме и совпадает с предельным диффузионным потоком к равнодоступной поверхности, равной внешней поверхности пористого материала:
скорость суммарного процесса определяется диффузией в объеме и совпадает с предельным диффузионным потоком к равнодоступной поверхности, равной внешней поверхности пористого материала: ![]() . Концентрация активного реагента даже на поверхности пористого материала, а тем более внутри пор растворяющегося вещества, гораздо меньше, чем в объеме. Эту предельную область называют внешней диффузионной.
. Концентрация активного реагента даже на поверхности пористого материала, а тем более внутри пор растворяющегося вещества, гораздо меньше, чем в объеме. Эту предельную область называют внешней диффузионной.
2. При ![]() и
и ![]() (Н – полная толщина пористого слоя; L – глубина проникновения реакции, вычисленная по формуле (9); rn - средний диаметр пор) определяющей стадией является диффузия в порах. Концентрация активного реагента на поверхности растворяющегося вещества близка к концентрации в объеме жидкой фазы, но по мере удаления от поверхности пористого материала в глубину пор она снижается практически до нуля. Эта область называется внутридиффузионной.
(Н – полная толщина пористого слоя; L – глубина проникновения реакции, вычисленная по формуле (9); rn - средний диаметр пор) определяющей стадией является диффузия в порах. Концентрация активного реагента на поверхности растворяющегося вещества близка к концентрации в объеме жидкой фазы, но по мере удаления от поверхности пористого материала в глубину пор она снижается практически до нуля. Эта область называется внутридиффузионной.
3. ![]() и
и ![]() концентрация активного реагента в порах твердого вещества совпадает с концентрацией в объеме жидкой фазы. Такая ситуация возникает, если пористый материал черезвычайно доступен в диффузионном отношении (вещества с большим диаметром пор, а коэффициент диффузии в объеме жидкой фазы имеет тот же порядок, что и коэффициент диффузии в порах) и в то же время обладает относительно низкой химической активностью по отношению к растворителю.
концентрация активного реагента в порах твердого вещества совпадает с концентрацией в объеме жидкой фазы. Такая ситуация возникает, если пористый материал черезвычайно доступен в диффузионном отношении (вещества с большим диаметром пор, а коэффициент диффузии в объеме жидкой фазы имеет тот же порядок, что и коэффициент диффузии в порах) и в то же время обладает относительно низкой химической активностью по отношению к растворителю.
В этой внутрикинетической области вся поверхность пористого материала взаимодействует с активным реагентом при одной и той же концентрации ![]() и микроскопическая скорость реакции пропорциональна объему пористого материала.
и микроскопическая скорость реакции пропорциональна объему пористого материала.
4. При ![]() и
и ![]() реакция протекает только на внешней поверхности пористого материала. Это означает, что вследствие относительно высокой химической активности или малой пористости (вещества с очень малым диаметром пор, т.е когда диаметр пор и диаметр молекул растворителя или растворенного вещества имеют один порядок) реагент не проникает в глубь пористого материала. В то же время предельный диффузионный поток из объема к внешней поверхности твердого вещества во много раз больше скорости химической реакции. Такая область называется внешнекинетической. Микроскопическая скорость в этой области пропорциональна внешней поверхности пористого материала.
реакция протекает только на внешней поверхности пористого материала. Это означает, что вследствие относительно высокой химической активности или малой пористости (вещества с очень малым диаметром пор, т.е когда диаметр пор и диаметр молекул растворителя или растворенного вещества имеют один порядок) реагент не проникает в глубь пористого материала. В то же время предельный диффузионный поток из объема к внешней поверхности твердого вещества во много раз больше скорости химической реакции. Такая область называется внешнекинетической. Микроскопическая скорость в этой области пропорциональна внешней поверхности пористого материала.
Другие рефераты на тему «Химия»:
- Влияние вида катализатора на параметры синтеза метанола
- Изучение процесса восстановления серебра в водных растворах
- Жидкокристаллические соединения
- Основы биохимии белков и аминокислот в организме человека
- Расчет двух ректификационных установок непрерывного действия для разделения смеси этилацетат – толуол
