Химический язык
Вопросы учащимся:
Почему нельзя хранить в химическом кабинете в одном и том же шкафу металлическое оборудование вместе с йодом, растворами кислот и солей?
Почему сельскохозяйственную технику (тракторы, комбайны) не рекомендуется хранить под открытым небом?
Цель работы: закрепление, совершенствование и углубление знаний и умений учащихся по электролизу.
Опыт 2. Электролиз раствор
а хлорида натрия.
Соедините провода с полюсами батарейки от карманного фонаря. Провод-анод вставьте в свежий срез клубня картофеля (среда, в которой распределяется раствор соли). Провод-катод с укрепленными на нем гвоздиком также вставьте в срез картофеля на расстоянии 1,5-2 см от первого электрода. На срез картофеля нанесите3-4 капли раствора хлорида натрия. У гвоздика поместите маленький кусочек фенолфталеиновой бумажки (рис.3). В таком положении оставьте установку на 15-20 минут. Какие происходят изменения на срезе картофеля? Чем объяснить эти изменения? Напишите уравнение реакции.
![]()
![]()
![]()
![]()
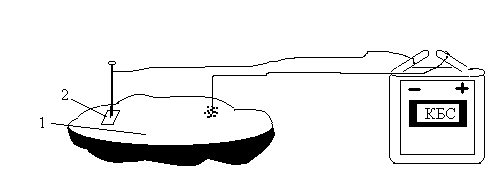
Рис.3. Электролиз раствора хлорида натрия: 1 – раствор хлорида натрия; 2 – фенолфталеиновая бумажка.
Опыт 3. Электролиз раствора хлорида натрия с применением бумажной диафрагмы.
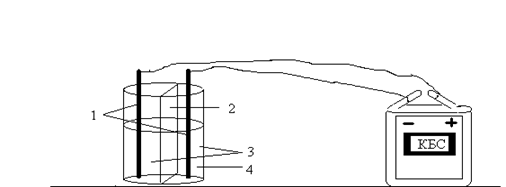 |
Рис.4. Электролиз раствора хлорида натрия с применением бумажной диафрагмы: 1 – стержни от карандаша; 2 – бумажная перегородка; 3 – раствор хлорида натрия; 4 – раствор фенолфталеина.
Опыт 4. Электролиз раствора хлорида натрия с применением пористой перегородки.
В стакане приготовьте 70-80 ìë раствора хлорида натрия. Тщательно вымойте яичную скорлупу, заполните ее на 3/4 раствором и опустите осторожно в стакан. В стакан и скорлупу на поверхности растворов опустите по кусочку фенолфталеиновой бумажки. Соедините графитовые стержни с проводами. Один стержень опустите в яйцо, второй - в стакан. Электроды (стержни с проводами) соедините с батарейкой (рис.5). Оставьте в таком положении установку на 35-40 мин. Раствор какого вещества образуется внутри скорлупы? Что образуется в анодном пространстве? Напишите уравнение реакции.
![]()
![]()
![]()
![]()
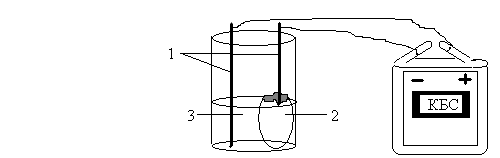
Рис.5. Электролиз раствора хлорида натрия с применением пористой перегородки: 1 – графитовые стержни; 2 – раствор хлорида натрия; 3 – раствор фенолфталеина. Напишите уравнение реакции.
Опыт 5. Электролиз раствора хлорида натрия в соленом огурце.
В срез соленого огурца вставьте кусочек медной проволоки и железный гвоздь. Медную проволочку соедините со знаком "+" батарейки, гвоздик - со знаком "-". У гвоздика на срез поместите кусочек фенолфталеиновой бумажки (Рис.6). Через 10-15 минут проследите за происходящими изменениями на срезе огурца.
![]()
![]()
![]()
![]()
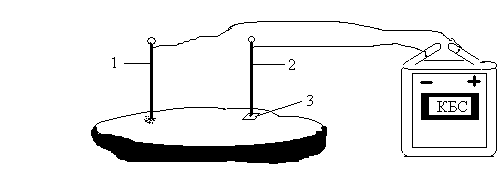
Рис.6. Электролиз раствора хлорида натрия в соленом огурце: 1 – медный электрод; 2 – железный электрод; 3 – фенолфталеиновая бумажка.
Цель работы: закрепление знаний и умений учащихся по окислительно-восстановительным реакциям.
Опыт 6. Горение сахара.
Измельченным чаем, который содержит растворимые соли лития (катализатор), посыпьте один из уголков кусочка сахара. Если чай плохо пристает к поверхности сахара, смочите его немного водой. Спичкой подожгите эту часть кусочка сахара. Каким пламенем он горит? Напишите уравнение реакции.
Опыт 7.
Во флаконе раздавите 3-4 ягоды смородины, налейте 1-2 мл воды, прилейте 1 мл раствора пероксида водорода и все это перемешайте. Какие происходят изменения в сосуде? Напишите уравнения реакции.
Приложение 8
Практическая работа: "Окислительно-восстановительные реакции".
Цель: развивать умения работы с веществами и оборудованием, умение применять теоретические знания для объяснения наблюдаемых явлений.
Оборудование: на столах учащихся пробирки, растворы K2SO3, KMnO4, KOH, HCl, CuSO4, KI, Н2SO4, гранулы цинка, алюминия, медная проволока.
Опыт 1. В 3 пробирки налейте раствор KMnO4, в первую добавьте раствор Н2SO4, во вторую – KOH, во все пробирки прилейте раствор K2SO3 до появления изменений. Запишите уравнения реакций, расставьте коэффициенты методом электронного баланса.
Опыт 2. В раствор HCl и CuSO4 положите гранулы алюминия. Запишите свои наблюдения, составьте уравнения реакций. Укажите причину протекания этих реакций.
Опыт 3. В две пробирки поместите гранулы цинка, прилейте соляную кислоту, к одной из гранул прикоснитесь медной проволокой, что наблюдаете? Объясните эти явления. Запишите процессы, происходящие при контакте меди с цинком.
Опыт 4. К раствору CuSO4 прилейте раствор KI. Что наблюдаете? Составьте уравнение реакции, если один из продуктов йодид меди (I).
Сделайте вывод по работе.
Приложение 9
Результаты анкетирования экспериментального класса:
|
ответы |
сложная |
пришлось подумать |
не очень сложная |
вообще не сложная |
|
% |
14 |
38 |
40 |
8 |
1 вопрос:
|
ответы |
они тянулись |
как обычно |
быстрее, чем раньше |
быстро, незаметно |
|
% |
5 |
5 |
27 |
63 |
