Оборудование для биотехнологического производства
При гидролизе растительного сырья разбавленными кислотами возникают трудности применения единого режима вследствие большой разницы в скоростях гидролиза гемицеллюлоз и целлюлозы. В некоторых случаях эта разница является полезной и на ее основе строятся специальные технологические режимы. Так, при раздельном использовании пентозных и гексозных гидролизатов в микробиологической промышленности реа
кцию гидролиза растительного сырья, богатого пентозанами, осуществляют последовательно в две ступени. Вначале, применяя мягкий режим гидролиза, в моносахариды превращают большую часть гемицеллюлоз, почти не затрагивая целлюлозу. После удаления пентозного гидролизата остаток, состоящий из целлюлозы и лигнина (целлолигнин), гидролизуется в более жестких условиях.
Аналогичный процесс осуществляется при получении из растительного сырья фурфурола и гексозного гидролизата. Такие процессы можно рассматривать как двухступенчатые.
Ступенчатый метод гидролиза имеет большое значение и для гидролиза целлюлозного остатка. При одноступенчатом гидролизе целлюлозы количество образующегося сахара z изменяется во времени по кривой, проходящей через максимум. Дальнейшее продолжение гидролиза нецелесообразно из-за снижения общего выхода сахара в результате энергично протекающей реакции его разрушения. Однако при максимальном выходе сахара значительная часть целлюлозы еще остается не гидролизованной и теряется для производства. Во избежание этих потерь был предложен многоступенчатый метод гидролиза растительной ткани. Первая ступень гидролиза проводится в мягких условиях, на этой ступени гидролизуются гемицеллюлозы. Затем полученный гидролизат удаляется из гидролизаппарата, а целлолигнин гидролизуется снова в более жестких условиях до момента, отвечающего максимальному выходу сахара. Полученный гидролизат второй ступени также удаляется, а оставшиеся полисахариды снова гидролизуются в аналогичных условиях. Этот процесс продолжается до тех пор, пока все полисахариды, содержащиеся в растительном сырье, будут гидролизованы.
При осуществлении этого способа гидролиза часть гидролизата предыдущей ступени остается в целлолигнине. Чтобы избежать возможной потери Сахаров при повторном гидролизе, после удаления гидролизата из целлолигнина последний промывается разбавленной кислотой и промывные воды присоединяются к основному гидролизату.
16. Мембранные методы выделения, концентрирования и обогащения продуктов биосинтеза
В настоящее время все большее распространение приобретают мембранные методы концентрирования и выделения различных веществ, хотя до сих пор в ряде производств БАБ (включая антибиотики, например, пенициллин) не удалось отказаться от традиционных способов выделения и очистки целевых продуктов (экстракция в системе "жидкость-жидкость", адсорбция на активированных углях, диализ).
Мембранные фильтры широко применяются в конструкциях небольших ячеек для культивирования клеток. Такие ячейки предназначены, как правило, для изучения действия факторов окружающей среды на популяцию клеток, обычно чистых культур, которые высеяны внутри ячейки. Во многих конструкциях ячеек использовались мембраны для ультрафильтрации или диализа (см. [230]), но микрофильтрационные мембраны намного лучше, поскольку они обеспечивают значительно более быструю диффузию питательных веществ и продуктов метаболизма клеток.
В зависимости от назначения можно конструировать ячейки самых разных типов. Главная идея состоит в том, чтобы диффузионная ячейка была изготовлена из инертного материала (плексигласа, поликарбоната) и включала в себя два мембранных фильтра, разделенных между собой достаточно большим просветом, необходимым для роста культуры клеток. Края мембранных фильтров должны быть хорошо загерметизированы, чтобы предотвратить подтекание растворов, но в то же времяотбор проб и демонтировка устройства не должны вызывать затруднений.
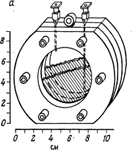
Рис. 11.1. Ячейка для культивирования, содержащая диализную мембрану для изучения загрязненности воды, а — схематическое изображение (из работы [149]); б — фото ячейки (любезно предоставлено Г. Мак-Фетерсомг Государственный университет Монтаны, США).
Загрязнение поверхности мембран особенно существенно, если ячейки работают на открытом воздухе, хотя в зависимости от характера эксперимента это может происходить и в лабораторных условиях. Органические вещества, бактерии и другие материалы могут легко адсорбироваться мембранными фильтрами и изменять их поверхность столь существенно, что ячейка для культивирования перестает работать, как положено. В сущности микроорганизмы, способные подвергать биодеградации матрицу мембраны (например, бактерии, разлагающие целлюлозу), могут образовывать колонии на внешней стороне мембраны и изменять характеристики ее проницаемости настолько, что она перестает функционировать должным образом.
Небольшие подвижные микроорганизмы, такие, как спирохеты, могут проникать через мембранные фильтры с размером пор 0,45 мкм. Хотя спирохеты, по-видимому, не могут пройти через мембраны с порами 0,22 мкм, скорость установления равновесия при "работе с мембранами со столь небольшими порами будет еще меньше по сравнению с той, которую мы рассмотрели выше, так что использование таких мембран будет малоэффективным. Из вышесказанного очевидно, что ячейки для культивирования этого типа будут работать должным образом лишь в том случае, если плотность популяции микроорганизмов вну+ри камеры невелика, и только при коротких периодах инкубации. Работа Мак-Фетерса и Стюарта [149] по выживанию ФКП в естественных водах была проведена с низкими плотностями популяции этих бактерий, и продолжительность опытов не превышала нескольких дней, так что использование подобных ячеек было оправдано. Другие области применения ячеек для культивирования в микробиологических исследованиях: для изучения процесса интродукции микроскопических грибов в почву с последующим анализом под электронным микроскопом. Репортер привел описание ячейки с мембранными фильтрами для изучения взаимодействия между корневыми .клетками растений и бактериями вида Rhizobium japonicum.
17. Особенности стерилизации разных субстратов. Горячая и холодная стерилизация
Под стерилизацией сред обычно понимают любой метод воздействия, обеспечивающий удаление из них микробов — контаминантов или разрушение последних. Наиболее распространенным и универсальным среди возможных методов, вызывающих деструкцию микроорганизмов, является метод, основанный на использовании влажного тепла.
Тепловую стерилизацию сред (по способу ее проведения) подразделяют на периодическую и непрерывную. При периодическом способе стерилизации процессы: нагрев, выдержка и охлаждение среды (рис. 98) протекают последовательно во време ни в одном аппарате. Это может быть ферментатор, посевной аппарат или специальный стерилизатор. Весь объем среды нагревают в аппарате до заранее выбранной температуры, выдерживают при этой температуре строго определенное время и охлаждают водой, подаваемой в рубашку аппарата или змеевик. Метод отличается простотой и надежностью, однако имеет и свои недостатки. В частности, ухудшается качество питательной среды из-за длительного воздействия высокой температуры, при этом происходит карамелизация Сахаров (образование ангидридов Сахаров), деструкция витаминов; излишне длительный нагрев приводит не только к разрушению питательных веществ, но и к образованию в среде потенциальных ингибиторов процесса ферментации, таких как аминосахара. Второй недостаток связан с тем, что требуется повышенный расход пара за короткий период нагрева. Третий недостаток обусловлен невозможностью регенерировать тепло. Последний, четвертый, недостаток касается трудности автоматизации процесса периодической стерилизации по сравнению с непрерывным.
Другие рефераты на тему «Производство и технологии»:
Поиск рефератов
Последние рефераты раздела
- Технологическая революция в современном мире и социальные последствия
- Поверочная установка. Проблемы при разработке и эксплуатации
- Пружинные стали
- Процесс создания IDEFO-модели
- Получение биметаллических заготовок центробежным способом
- Получение и исследование биоактивных композиций на основе полиэтилена высокой плотности и крахмала
- Получение титана из руды
