Закон природы
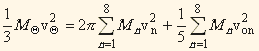
где vоn – экваториальная скорость вращения n-ой планеты.
Закон сохранения полного момента количества движения в Солнечной системе без доказательства следует из следующего выражения:
![]()
Расчет по этой формуле дает ошибку в 1.6
%. Принципиально не важна последовательность рождения планет, а важно только то обстоятельство, что каждое новое рождение планеты связано с переходом через оболочку порождающей ее звезды или планеты. По-видимому, внутренние планеты были сформированы непосредственно Солнцем, а внешние планеты Юпитер и Сатурн сформировались совместно в процессе рождения Солнца путем распада их общей оболочки на три независимых пузыря.
Изменение потенциальной энергии системы, взятое с обратным знаком, равно работе внутренних консервативных сил:
– DEп = Aкс
Согласно второму закону Кеплера, каждая планета движется в плоскости, проходящей через центр Солнца, причем площадь сектора орбиты, описанная радиусом-вектором планеты, изменяется пропорционально времени. Применительно к нашей Солнечной системе, с этим законом связаны два понятия: перигелий – ближайшая к Солнцу точка орбиты, и афелий – наиболее удаленная точка орбиты. Тогда можно утверждать, что планета движется вокруг Солнца неравномерно: имея линейную скорость в перигелие больше, чем в афелие.
5. Какие типы связей имеют место в кристаллах? Опишите модификации углерода. Почему столь многообразны соединения углерода? Какие особенности строения атома углерода определили его роль в живой природе?
В кристаллах имеют место следующие типы связей:
Ковалентная связь;
Ионная связь;
Металлическая связь;
Молекулярная связь;
Водородная связь.
Рассмотрим их подробнее.
Ковалентная связь
Нейтральные атомы размещены в узлах кристаллической решётки. Связь образуется направленными валентными электронными облаками.
Связь, объединяющая в кристалле (а также и в молекуле) нейтральные атомы, называется гомеополярной или ковалентной. Силы взаимодействия при гомеополярной связи имеют, как и в случае с гетерополярной связью, электрический (но не кулоновский) характер. Гомеополярная связь осуществляется электронными парами. Это означает, что в обеспечении связи между двумя атомами участвует по одному электрону от каждого атома. По этой причине гомеополярная связь имеет направленный характер.
Кристаллы с ковалентной связью диэлектрики или полупроводники. Типичными примерами атомных кристаллов могут служить алмаз, германий и кремний.
Ионная связь
В узлах кристаллической решетки помещаются положительно и отрицательно заряженные ионы.
Силы взаимодействия между узлами являются в основном электростатическими (кулоновскими). Связь между такими частицами называется гетерополярной или ионной.
Кристаллы с ионной связью при низких температурах являются диэлектриками. При тепературах близких к температуре плавления они становятся проводниками электричества. Примером кристаллов с ионной решёткой являются кристаллы каменной соли (NaCl).
Металлическая связь
Во всех узлах кристаллической решетки расположены положительные ионы металла. Между ними беспорядочно, подобно молекулам газа, движутся электроны, отщепившиеся от атомов при образовании ионов. Эти электроны играют роль цемента, удерживая вместе положительные ионы; в противном случае решетка распалась бы под действием сил отталкивания между ионами. Вместе с тем и электроны удерживаются ионами в пределах кристаллической решётки и не могут её покинуть.
Большинство металлов имеет кристаллические решетки одного из трёх типов: кубическую объёмно-центрированную, кубическую гранецентрированную и, так называемую, плотную гексагональную.
По схемам металлических кристаллических решеток видно, что кубическая гранецентрированная и плотная гексагональная решётки соответствуют наиболее плотной упаковке одинаковых шаров (частиц). Кристаллы с металической связью являются проводниками. Они часто плаcтичны, так как при смещении атомов друг относительно друга не происходит разрыв связей.
Молекулярная связь
В узлах кристаллической решетки помещаются определенным образом ориентированные молекулы. Силы связи между молекулами в кристалле имеют ту же природу, что и силы притяжения между молекулами, приводящие к отклонению газов от идеальности. По этой причине их называют ван-дер-ваальсовскими силами.
Для кристаллов с молекулярными связями характерны низкие температуры плавления и высокая сжимаемость.
Водородная связь
Особая разновидность молекулярной связи – водородная связь. Это самая сильная молекулярная связь. При определённых условиях атом водорода может быть связан довольно прочно с двумя другими атомами. Имея лишь одну стабильную орбиталь, атом водорода способен образовывать только одну ковалентную связь. Эта связь может, однако, резонировать между двумя положениями. Наибольшее значение имеют те водородные связи, которые образуются между двумя сильно электроотрицательными атомами, в особенности между атомами азота, кислорода и фтора.
Водородные связи, образуемые молекулами воды, обусловливают удивительно высокие точки плавления льда и кипения воды, существование максимума плотности воды, расширение воды при замерзании. Многие особые свойства неорганических и органических молекул, например димеризация жирных кислот, объясняются образованием водородных связей. Водородная связь – особенно важная структура белков особенность белков и нуклеиновых кислот.
Молекулярные связи образуют, например, следующие вещества: H2, N2, O2, CO2, H2O.
Типы химической связи – это удобное упрощение. Более точно поведение электрона в кристалле описывается законами квантовой механики. Говоря о типе связи в кристалле, необходимо иметь в виду следующее: связь между двумя атомами никогда полностью не соответствует одному из описанных типов. В ионной связи всегда присутствеет элемент ковалентной связи и т.п.
Многообразие соединения углерода связано с тем, что в сложных веществах связь между разными атомами может быть разного типа. Так например, в кристалле белка связь в молекуле белка ковалентная, а между молекулами (или разными частями одной молекулы) водородная.
Существуют четыре аллотропных модификации углерода: алмаз, графит, карбин и букибол.
Кристаллическая решетка алмаза состоит из атомов углерода, соединенных между собой очень прочными s-связями. В кристалле алмаза все связи эквивалентны и атомы образуют трехмерный каркас из сочлененных тетраэдров. Алмаз – самое твердое вещество, найденное в природе.
Графит представляет собой темно-серое с металлическим блеском, мягкое, жирное на ощупь вещество. Хорошо проводит электрический ток. В графите атомы углерода расположены в параллельных слоях, образуя гексагональную сетку. Внутри слоя атомы связаны гораздо сильнее, чем один слой с другим, поэтому свойства графита сильно различаются по разным направлениям.
Другие рефераты на тему «Биология и естествознание»:
Поиск рефератов
Последние рефераты раздела
- Влияние экологических факторов на разнообразие моллюсков разнотипных искусственных и естественных водоемов
- Влияние экологии водоемов на биологическое разнообразие фауны
- Влияние фтора и фторосодержащих соединений на здоровье населения
- Влияние факторов внешней среды на микроорганизмы
- Влияние физической нагрузки на уровень адренокортикотропного гормона, адреналина, кортизола, кортикостерона в сыворотке крови спортсменов
- Временные аспекты морфогенетических процессов. Эволюция путем гетерохронии
- Вопросы биоэтики
