Синтез оксима циклогексанона
ИК спектры оксимов имеют 2 слабые полосы поглощения при 3650-3500 и 1690-1650 см -1, отвечающие валентным колебаниям О—Н и C=N связей соотв., и сильную полосу при 960-930 см -1 (валентные колебания N—О-связи). [10]
Методы синтеза
Наиболее распространенным лабораторным методом оксимов является реакции альдегидов и кетонов с гидроксиламином
CH3COCH3 + NH2OH ="Рисунок 55" src="images/referats/9537/image006.png" alt="Описание: \to">CH3(C=N-OH)CH3 + H2O
Другим широко используемым методом является изомеризация нитрозосоединений, образующихся in situ при нитрозировании некоторых алканов (например, циклогексана нитрозилхлоридом NOCl) или соединений с активированной метильной либо метиленовой группой:
PhCOCH3 + C5H11ONO ![]() [ PhCOCH2N=O ]
[ PhCOCH2N=O ] ![]() PhCOCH=N-OH
PhCOCH=N-OH
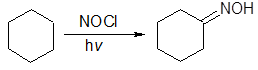
Оксимы также могут быть синтезированы окислением первичных аминов:
RR1CH-NH2 + H2O2 ![]() RR1C=NOH + H2O
RR1C=NOH + H2O
либо восстановлением нитросоединений:
RCH2NO2 + [H] ![]() RCH=NOH + H2O
RCH=NOH + H2O
Применение
Образование оксимов используют для выделения, идентификации и количеств. определения карбонильных соединений. Некоторые оксимы – аналитические реагенты, например диметилглиоксим применяют для разделения и концентрирования Ni (II), Pd(II) и Re(IV), 1,2-диоксимы – для определения Ni, Co, Сu и платиновых металлов, 2,2'-фурилдиоксим [1,2-(2-фурил)этандион-диоксим] – для определения Pd в рудах, формальдоксим – реагент для фотометрия, определения Mn(III), Ce(IV), V(V) в щелочной среде. Оксимы применяют для получения пестицидов (например, бутокарбоксим, бутоксикарбоксим), лекарственных препаратов (например, 2-пиридин-альдоксимметиодид), циклогексаноноксим используется в производстве капролактама. [7]
1.3 Химические свойства оксимов
Оксимы проявляют амфотерные свойства, являясь как очень слабыми основаниями, так и слабыми кислотами.
Под действием алкоголятов щелочных металлов оксимы депротонируются, образуя соответствующие соли, такие соли алкилируются алкилгалогенидами с образованием O-алкилоксимов:
RR1C=NOH + C2H5ONa ![]() RR1C=NONa + C2H5OH
RR1C=NONa + C2H5OH
RR1C=NONa + R2I ![]() RR1C=NOR2 + NaI
RR1C=NOR2 + NaI
Оксимы также могут образовывать соли с переходными металлами, в последнем случае возможно комплексообразование, особенно в случае бидентантных оксимов. Так, например, диметилглиоксим (реактив Чугаева) образует с двухвалентным никелем прочный нерастворимый комплекс; эта реакция используется для гравиметрического определения никеля.
Энергичными восстановителями оксимы восстанавливаются до аминов, также возможно восстановление до N-замещенных гидроксиламинов.
Оксимы дегидрируются с образованием иминоксильных радикалов:
R2C=NOH ![]() R2C=N-O
R2C=N-O
Под действием перокситрифторуксусной кислоты, получаемой in situ из трифторуксусного ангидрида и перекиси водорода оксимы окисляются до нитросоединений; в случае циклогексаноноксима реакцию проводят в кипящем ацетонитриле в присутствии буфера, при окислении оксимов α-дикетонов в α-нитрокарбонильные соединения в качестве растворителя может быть использован хлороформ или трифторуксусная кислота, необходимости в буфере в этом случае нет, предполагается, что первоначально образуется аци-форма нитросоединения, которая затем таутомеризуется:
RCOCR=NOH + CF3COOOH ![]() RCOCR=NO(OH)
RCOCR=NO(OH) ![]() RCOCHRNO2
RCOCHRNO2
N-бромсукцинимид (NBS) реагирует с оксимами с образованием соответствующего гем-бромнитрозопроизводного:
R2C=NOH + NBS ![]() R2CBr(NO)
R2CBr(NO)
Под действием азотной кислоты оксимы дают гем-нитронитрозосоединения:
R2C=NOH + HNO3 ![]() R2CNO(NO2)
R2CNO(NO2)
Под действием кислотных и ацилирующих агентов (PCl5, P2O5, полифосфорные кислоты, хлорангидриды сульфокислот и карбоновых кислот) альдоксимы отщепляют воду с образованием нитрилов:
RCH=NOH + Ac2O ![]() RCN + 2 AcOH
RCN + 2 AcOH
Кетоксимы в таких условиях перегруппировываются в амиды (перегруппировка Бекмана), перегруппировка стереоспецифична - к азоту мигрирует радикал, находящийся в транс-положении к гидроксилу:
RR1CH=NOH ![]() RCONHR1
RCONHR1
Перегруппировка Бекмана циклогексаноноксима является промышленным методом синтеза капролактама - мономера капрона (найлона-6):
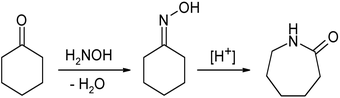
Перегруппировку Бекмана также претерпевают O-замещённые кетоксимы (сложные эфиры оксимов, перегруппировка Бекмана-Чепмена):
RR1CH=NOR2 ![]() RCONR1R2
RCONR1R2
1.4 Перегруппировка Бекмана
Перегруппировка Бекмана – изомеризация кетоксимов в N-замещенные амиды карбоновых кислот под действием кислотных агентов. Механизм реакции:
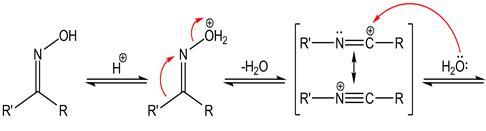
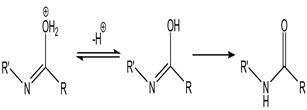
Реакция экзотермична. Кислотными агентами служат полифосфорные кислоты, пентахлорид и пентаоксид фосфора, хлорангидриды сульфокислот, карбоновых кислот и др. Процесс обычно проводят в пиридине, этиловом эфире или бензоле; скорость его сильно возрастает с ростом полярности растворителя. Реакция одинаково хорошо осуществляется с оксимами алифатических и ароматических кетонов. Оксимы жирноароматических кетонов всегда превращаются в ацильные производные ароматических аминов. В случае циклических кетонов происходит расширение цикла.
Перегруппировка Бекмана стереоспецифична: всегда мигрирует радикал, находящийся в транс-положении к гидроксилу. Конфигурация атомов С в R' сохраняется. Установлено, что перегруппировываются не сами кетоксимы, а продукты их взаимодействия с реагентами. Так, в случае ацилирующих агентов образуется ацильное производное, последующий распад которого происходит с разрывом связи N—О и синхронной миграцией R'.
