Методы определения хлорид-ионов
1. Аg+ + Сl-→AgCl
2. 2Аg+ + СгО42-→ Аg2СгO4
Результатом первой реакции (образование хлористого серебра) служит появление белых вкраплений или молочное окрашивание раствора. Образование красного хромата серебра начинается лишь после того, как все ионы хлора оказываются связанными в хлористое серебро. После этого нитрат серебра вступает в реакцию с индикаторным раствором хрома
та калия, в результате чего образуется хромат серебра. Таким образом, для нормального протекания обеих реакций фильтрат должен иметь слабощелочную реакцию, (рН = 8.3). При высоком рН происходит выпадение осадка окиси серебра.
Оборудование
Шприц со стеклянным наконечником, 5 мл; мерный стакан, 400 мл, стеклянный; магнитная мешалка с «микромешалками»
Реактивы:
Дистиллированная вода, раствор хромата калия, индикаторный раствор фенолфталеина, раствор серной кислоты 0,1 N, раствор нитрата серебра, растворитель Arcosolv PNP.
Методика определения
Для начала определите щелочность цельного бурового раствора:
1. Внесите 100 мл растворителя Arcosolv PNP в 400-мл мерный стакан.
2. Наберите в 5-мл шприц не менее 3 мл цельного бурового раствора и введите 2 мл в мерный стакан.
3. Взбалтывайте смесь круговыми движениями до достижения однородности.
4. Добавьте 200 мл дистиллированной воды. Добавьте 15 капель индикаторного раствора фенолфталеина.
5. Перемешивая смесь магнитной мешалкой, медленно титруйте 0,1N серной кислотой до начала исчезновения розовой окраски. Продолжайте перемешивать смесь в течение еще одной минуты и, если розовая окраска не появится вновь, прекратите перемешивание. Иногда бывает необходимо прекратить перемешивание, чтобы обеспечить разделение обеих фаз и возможность более четкого визуального определения цвета водной фазы.
6. Оставьте образец на 5 минут, и если розовая окраска не появится вновь, то это будет свидетельствовать о достижении конечной точки титрования. В случае возобновления розовой окраски проведите повторное титрование серной кислотой. Если розовая окраска окончательно не исчезает, оттитруйте смесь в третий раз, однако в случае возобновления окраски после третьего титрования следует прекратить дальнейшие попытки и принять полученный результат за конечную точку.
7. Закончив определение щелочности, обеспечьте наличие кислой реакции (рН < 7) у смеси, которую предполагается титровать на содержание хлоридов, путем добавления 10–20 капель 0,1 Н серной кислоты.
8. Добавьте 3,0 мл индикаторного раствора хромата калия.
9. Перемешивая смесь с помощью магнитной мешалки, медленно титруйте ее 0.282N раствором нитрата серебра до появления оранжево-розовой окраски, сохраняющейся на протяжении как минимум одной минуты. Иногда бывает необходимо прекратить перемешивание, чтобы обеспечить разделение обеих фаз и возможность более четкого визуального определения цвета водной фазы. 10. Расчет содержания хлоридов в цельном буровом растворе основывается на суммарном количестве миллилитров 0.282N нитрата серебра, потребовавшемся для достижения конечной точки титрования.
Расчет содержания хлоридов осуществляется по формуле:
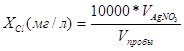 (.2)
(.2)
3 Методика количественного химического анализа мясных продуктов на содержание хлоридов методом ионной хроматографии
Проба экстрагируется по ГОСТ 9957–73 дистиллированной водой. Отделение анионов хлоридов производится хроматографически на ионообменной колонке с последующим кондуктометрическим детектированием. Относительная погрешность определения хлорид-иона в диапазоне 1–5% составляет 0.1%(2% отн.).
Оборудование: хроматограф жидкостный ионный «Цвет-3006М» ТУ 5Е1.550.186 или другой жидкостный ионный хроматограф; весы аналитические ВЛА-200г-М, ГОСТ 24104–89; колбы мерные на 50, 100, 200 и 1000 см3, ГОСТ 1770–74; пипетки мерные вместимостью 1, 2, 5, 10 и 25 см3, ГОСТ 20292–74; колбы конические вместимостью 100 или 200 см3, ГОСТ 10394–72; электромясорубка бытовая по ГОСТ 20469–81; насос вакуумный типаВМ-461; водяная баня; воронки стеклянные, ГОСТ 8613–75; фильтры беззольные бумажные; стакан химический вместимостью 200–250 мл по ГОСТ 10394–72.
Реактивы и материалы.
1. Калий хлористый, х.ч., по ГОСТ 4234–77.
2. Сорбент катионообменный КРС-8п ТУ 6–09–10–151–79.
3. Натрий углекислый кислый, хч, по ГОСТ 4201–79.
4. Натрий углекислый, хч, по ГОСТ 83–79.
5. Кислота азотная, хч, по ГОСТ 4461–77.
6. Вода бидистиллированная, ГОСТ 6709072 или деионизованная.
7. Сорбент анионообменный КанК-Аст ВТУ 881202–89.
Подготовка проб к анализу
Отобранный образец измельчается мясорубкой. 5 г измельченной средней пробы взвешивают в химическом стакане с погрешностью + 0,01 г. и добавляют 200 мл дистиллированной воды. Через 40 мин настаивания (при периодическом помешивании стеклянной палочкой) водную вытяжку фильтруют через бумажный фильтр. Для определения хлоридов берут 1 мл водной вытяжки в мерную колбу на 100 мл и доводят до метки дистиллированной водой. Полученный раствор используют для ввода в хроматограф.
Выполнение измерений
Готовят градуировочные растворы объемно-весовым методом. Для приготовления исходного раствора хлорид-иона концентрацией 1 г/л необходимо взять навеску 2,1 г хлористого калия и растворить в дистиллированной воде в отдельной мерной колбе вместимостью 1000 мл.
Установку и включение хроматографа осуществляют в соответствии с инструкциями по эксплуатации хроматографа Цвет-3006М. На насосе задают расход элюента 2,0 см3/мин, шкалу чувствительности устанавливают «32». Устанавливают режимные параметры и вводят градуировочный раствор в дозатор хроматографа. Снимают хроматограммы стандартных растворов. Градуировочный коэффициент К для хлорид ионов рассчитывается по формуле:
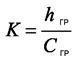 (.4)
(.4)
где hгр – высота пика компонента в градуировочном растворе, мм;
Сгр – концентрация компонента в градуировочном растворе, мг/л.
Проведение анализа
Вводят в хроматограф водную вытяжку для определения хлорид-иона. Снимают хроматограмму. Время выхода пика хлорида 10 мин. Концентрацию хлорид-иона в пробе (Спробы) вычисляют по формуле:
Спробы(мг/кг)=![]() (.5)
(.5)
где hпр – высота пика компонента в пробе, мм;
М – навеска пробы, г.
4 Аргентометрическое определение хлоридов в воде
Метод основан на титровании хлорид-ионов раствором нитрата серебра в нейтральной или слабощелочной среде (рН=6,5–10) в присутствии индикатора K2CrO4.
Сl- + Ag+ → AgCl ↓
Определению мешает присутствие ионов РО43 – (> 25 мг/л), Fe3+ (> 10 мг/л) и катионов, образующих осадки с Сl –.
Рабочий раствор нитрата серебра готовят следующим образом: AgNO3– 2,4 г AgNO3 помещают в мерную колбу на 1 литр и доводят дистиллированной водой до метки. Точную концентрацию устанавливают по раствору NaCl, приготовленному из фиксанала или по точной навеске.
