Производство ацетилена
2). Электрокрекинг при помощи вольтовой дуги, когда углеводородное сырье подвергают пиролизу в электродуговых печах при напряжении между электродами 1000 В. Затраты электроэнергии доходят до 13 000 кВт-ч на 1 т ацетилена, что составляет главный недостаток метода.
3). Гомогенный пиролиз, когда сырье вводят в поток горячего топочного газа, полученного сжиганием метана в кислороде и имеющего т
емпературу 2000°С. Этот метод можно комбинировать с другими процессами пиролиза, если в горячие газы первой ступени пиролиза вводить пары жидких углеводородов, для расщепления которых в ацетилен требуется более низкая температура. Возможно и совместное получение ацетилена и этилена.
4). Окислительный пиролиз, при котором экзотермическая реакция горения углеводородов и эндотермический процесс пиролиза совмещены в одном аппарате.
Все эти способы пиролиза углеводородов на ацетилен применяют в промышленности, но наиболее экономичным из них является окислительный пиролиз.
4. Физико-химические основы процесса получения ацетилена методом термоокисленного пиролиза метана.
Из метана и других парафинов ацетилен получают путем высокотемпературного пиролиза по следующим обратимым реакциям:
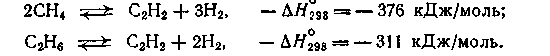
Эти реакции эндотермичны, и их равновесие смещается вправо только при 1000—1300°С. Однако при практическом осуществлении процесса с целью его ускорения требуется более высокая температура: 1500—1600°С для метана и 1200°С для жидких углеводородов.
Подобно пиролизу на олефины, реакции образования ацетилена имеют радикально-цепной механизм, причем цепь превращений метана и этана можно представить примерно так:
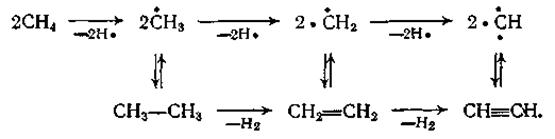
В полученном газе кроме низших парафинов и олефинов содержится небольшое количество бензола и ацетиленовых углеводородов — метилацетилена СН3—С![]() СН, а также винилацетилена СН2=СН—С
СН, а также винилацетилена СН2=СН—С![]() СН, диацетилена СН
СН, диацетилена СН![]() С—C
С—C![]() CH и др.
CH и др.
Получение ацетилена данным методом осложняется побочной реакцией его разложения на углерод и водород. Она становится заметной при 1000°С и достигает значительной скорости при 1200—1600°С, т. е. при температуре, требуемой для получения ацетилена. В результате наблюдается система последовательных реакций, при которой образующийся ацетилен разлагается на водород и углерод (сажу):
![]()
Как и в других подобных случаях, регулирование выхода промежуточного продукта может быть достигнуто уменьшением степени конверсии исходного углеводорода в результате снижения времени контакта. Найдено, что хороший выход ацетилена при небольшом образовании сажи можно получить при степени конверсии исходного углеводорода 50 % и времени его пребывания в зоне реакции 0,01 с. Во избежание дальнейшего разложения ацетилена необходима быстрая «закалка» реакционных газов (впрыскивание воды), при этом температура резко снижается до такой величины, при которой распада ацетилена не происходит.
При недостатке кислорода и высокой температуре сгорание метана происходит в основном по реакции:
СН4 + О2 → СО + Н2 + Н2О, ![]() = 272,2 кДж/моль.
= 272,2 кДж/моль.
Она протекает очень быстро, и образование ацетилена (как более медленный процесс) начинается лишь в зоне, практически лишенной кислорода. Там же происходит конверсия оксида углерода
СО + Н2О ↔ СО2 + Н2,
причем соотношение водорода, оксидов углерода и водяных паров оказывается близким к этому равновесию водяного газа. В практических условиях около 1/3 кислорода расходуется на образование воды, 10—15 % на СО2 и 50—55 % на СО.
Поскольку процесс протекает в автотермическом режиме, для поддержания температуры ![]() 1500°С, необходимой для разложения метана, соотношение начальных объемов СН4 и О2 должно составлять 100:(60
1500°С, необходимой для разложения метана, соотношение начальных объемов СН4 и О2 должно составлять 100:(60![]() 65), что находится вне пределов взрываемости этих смесей. Опасные концентрации могут возникнуть лишь во время смешения, проводимого при достаточно высокой скорости и турбулентности потока газов. Само горение метана характеризуется некоторым периодом индукции, длительность которого зависит от температуры и давления. Для метано-кислородных смесей указанного выше состава при атмосферном давлении и 600 °С период индукции составляет
65), что находится вне пределов взрываемости этих смесей. Опасные концентрации могут возникнуть лишь во время смешения, проводимого при достаточно высокой скорости и турбулентности потока газов. Само горение метана характеризуется некоторым периодом индукции, длительность которого зависит от температуры и давления. Для метано-кислородных смесей указанного выше состава при атмосферном давлении и 600 °С период индукции составляет ![]() 2с, что ограничивает время от смешения предварительно подогретых газов до их попадания в горелки, где происходит самовоспламенение смеси. Скорость течения газа в сопле горелки (
2с, что ограничивает время от смешения предварительно подогретых газов до их попадания в горелки, где происходит самовоспламенение смеси. Скорость течения газа в сопле горелки (![]() 100 м/с) должна быть выше скорости распространения пламени, чтобы возникшее пламя не распространялось в обратном направлении. В то же время при стабильном режиме горения скорость газа не должна быть выше скорости гашения пламени, чтобы оно не отрывалось от горелки. При турбулентном потоке устойчивому горению способствуют подвод дополнительного количества кислорода в зону горения (так называемый стабилизирующий кислород), а также многосопловые устройства со множеством факелов горения, стабилизующих друг друга.
100 м/с) должна быть выше скорости распространения пламени, чтобы возникшее пламя не распространялось в обратном направлении. В то же время при стабильном режиме горения скорость газа не должна быть выше скорости гашения пламени, чтобы оно не отрывалось от горелки. При турбулентном потоке устойчивому горению способствуют подвод дополнительного количества кислорода в зону горения (так называемый стабилизирующий кислород), а также многосопловые устройства со множеством факелов горения, стабилизующих друг друга.
5. Аппаратурно-технологическая схема
Технологическая схема получения ацетилена окислительным пиролизом метана изображена на рис. 2. Кислород и метан подогревают до 600—700 °С в трубчатых печах 1 и 2, имеющих топки для сжигания природного газа. В реакторе 3 протекают вышерассмотренные процессы, причем газы выходят из него после «закалки» водой при 80 °С и проходят для улавливания сажи полый водяной скруббер 4 и мокропленочный электрофильтр 5. Газы охлаждают водой в холодильнике 6 непосредственного смешения, после чего их промывают в форабсорбере 7 небольшим количеством диметилформамида или N-метилпирролидона и направляют в газгольдер 8. Вода, стекающая из гидравлического затвора реактора и из сажеулавливающих аппаратов, содержит 2—3 % сажи, а также малолетучие ароматические соединения. Она поступает в отстойник 9, с верха которого сажу и смолы собирают скребками и направляют на сжигание. Воду из отстойника возвращают в реактор как «закалочный агент», а ее избыток идет на очистку, чем создается замкнутая система водооборота без сбрасывания токсичных сточных вод.
Газ из газгольдера 8 сжимается компрессором 10 до давления ![]() 1 МПа, проходя после каждой ступени холодильники и сепараторы, не показанные на схеме. В абсорбере 11 он промывается диметилформамидом или N-метилпирролидоном, а непоглотившийся газ (Н2, СН4, СО, СО2) проходит скруббер 12, где при орошении водным конденсатом улавливается унесенный им растворитель. После этого газ можно использовать в качестве синтез-газа или топлива.
1 МПа, проходя после каждой ступени холодильники и сепараторы, не показанные на схеме. В абсорбере 11 он промывается диметилформамидом или N-метилпирролидоном, а непоглотившийся газ (Н2, СН4, СО, СО2) проходит скруббер 12, где при орошении водным конденсатом улавливается унесенный им растворитель. После этого газ можно использовать в качестве синтез-газа или топлива.
