Введение в теорию многоэлектронного атома. Элементы теории многоэлектронных атомов
Отдельные диагональные слагаемые этой таблицы равны Vi= –Ze2/ri. Каждое из них представляет из себя энергию электростатического кулоновского притяжения одного из электронов к ядру. Недиагональные слагаемые Vij=+Ze2/rij. Полное выражение электростатической потенциальной энегии в атоме: ![]() Результирующий эффективный потенциал межэлек
Результирующий эффективный потенциал межэлек
тронного отталкивания превращается в эффективный потенциал "экранирования" ядра:
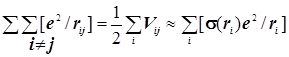
s(ri) - заряд экранирования (функция экранирования) отдельного электрона внутренними электронами, более близкими к ядру.
В этом случае потенциальная кулоновская энергия притяжения всех электронов к ядру дополняется эффективной потенциальной функцией экранирования ядра, и получается эффективное приближённое аддитивное выражение для всей кулоновской потенциальной энергии электронной оболочки
![]()
Микросостояния и атомные термы в приближении Рассела-Саундерса.
Этот раздел целесообразно рассмотреть на конкретных примерах.
Содержание. Электронная конфигурация. Микросостояния и их систематизация. Порядок учёта кулоновских взаимодействий и постадийная классификация дискретных электронных уровней и состояний атома (электронно-ядерное притяжение и орбитальные уровни, межэлектронное отталкивание и атомные термы Рассел-Саундерса, спин-спиновая корреляция и запрет Паули). Суммарные квантовые числа ML,MS,L,S. Атомное внутреннее квантовое число J. Термы нормальные и обращённые. Правила Хунда (1-е, 2-е и 3-е). Относительная шкала энергии атомных термов. Спектральные переходы и правила отбора. Атомные уровни в магнитном поле, эффект Зеемана (практикум).
Электронная конфигурация представляет собой исходное понятие. Оно определяется в нулевом приближении в оценке энергии. Далее постепенно учитываются всё более тонкие взаимодействия, и возникает более точная картина состояний и уровней многоэлектронного атома. Если атомный подуровень заселён неполностью, то возникает несколько различных микросостояний. Их характеристики непосредственно определяются комбинаторикой размещений электронов в системе спин-орбиталей.
Если n электронов заселяют g спин-орбиталей, то одно из формальных обозначений конфигурации (g,n). В её пределах число возможных микросостояний определяется согласно статистике Ферми: W(g,n) = g! / [n! (g - n) !].
Пример 1: основная электронная конфигурация атома углерода C (1s22s22p2)
Конфигурация p2 (атомы IV группы элементов C, Si. .). W(6,2) = 6! / [2! (6 - 2) !] =15
|
Перечислим все возможные варианты орбитальных размещений и спиновых комбина-ций 2-х электронов на трёх АО: |
Орбитальные распределения двух электронов
|
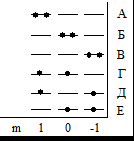
Возможно всего шесть размещений внутри p-АО без учёта спина Орбитальные распре-деления можно охарак-теризовать комбинаци-ями квантовых чисел частиц (m1, m2): (+1,+1) А (0, 0) Б (- 1, - 1) В (+1, 0) Г (+1, - 1) Д (0, - 1) Е |
Комбинации пространственных (орбитальных) состояний частиц в коллективе легко описать разными способами. Возможные спиновые комбинации в системе двух частиц-фермионов с половинным спином (электронов, протонов,. .) можно представить разными способами. Можно изобразить ориентации спинов разными символами (стрелками, знаками или греческими буквами). Результат сложения компонент момента импульса вдоль оси вращения представми в одной из строк таблицы значениями суммарного магнитногоквантового числа. Все возможные комбинации спиновых векторво отдельных электронов попадут в таблицу:
|
Способ 1 |
|
Ї |
Ї |
ЇЇ |
Эти три способа |
|
Способ 2 |
(++) |
(– +) |
(–+) |
(– –) |
Описания |
|
Способ 3 |
aa |
ab |
ba |
bb |
Идентичны |
|
Можно как-либо еще, а в итоге будет: |
где MS(1,2) = mS(1) + mS(2) | ||||
|
MS(1,2) |
1 |
0 |
0 |
-1 | |
|
MS(1,2) |
+1 |
0 |
–1 | |
|
Микросостояния в рамке, выделенные на тёмном фоне, принципу Паули не удовлетворяют и должны быть исключены из дальнейшего анализа |
A |
А А |
А | |
|
A |
Б Б |
A | ||
|
A |
В В |
A | ||
|
Г |
Г |
Г |
Г | |
|
Д |
Д |
Д |
Д | |
|
Е |
Е |
Е |
Е | |