Исследование свойств продуктов циклизации алициклического 1,5,9-трикетона
|
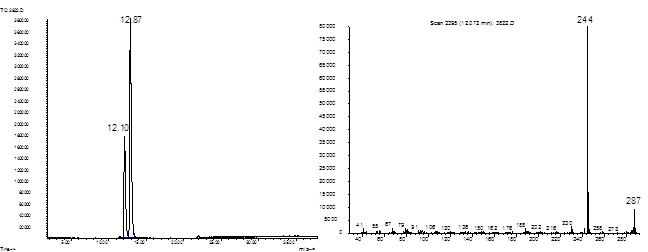
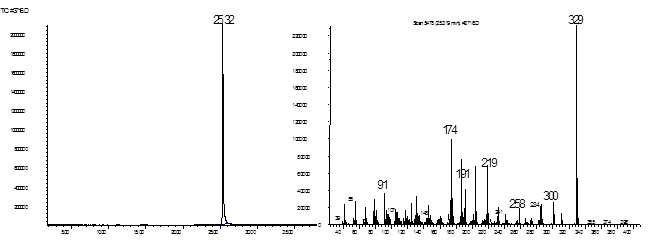 Рис. 8. Хроматограмма и масс
Рис. 8. Хроматограмма и масс-спектр соединения 23.
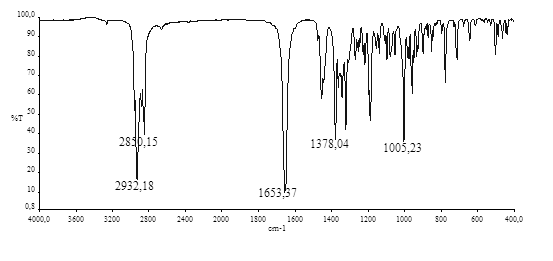
В ИК спектре содержится полоса поглощения амидной группы при 1653 см-1.
Рис. 9. ИК спектр соединения 23 в KBr.
Спектр ЯМР 1Н (d, м.д.) (рис. 10) содержит синглетный сигнал водорода формильной группы при 8.38, дублетный сигнал водорода (1Н, С22-Н) при 3.59 (J=3,42 Гц), мультиплетный сигнал при 2.55 (1Н, С12-Н).
В спектре ЯМР 13С (d, м.д.) (рис. 11) содержатся сигнал углерода формильной группы (С23) при 159.11, четвертичного углерода (С1), связанного с N- и O-атомами при 82.60, четвертичного углерода (С19), связанного с О-атомом при 77.62, третичного углерода (С22), связанного с N-атомом при 60.40, сигналы трех третичных С-атомов (С6, С12, С14) при 41.64, 41.04, 28.48, четвертичного углерода (С8) при 33.73.
Образование соединения 23 из соединений 21 или 22 в результате реакции формилирования представлено на схеме (6):
Схема 6
Для подтверждения пути образования соединения 23 по направлению a или b мы ввели в реакцию Лейкарта кетон 22. По данным ГЖХ-МС реакционная смесь на 30 % состояла из соединения 23 и более чем на 60 % - из соединения 26, которое является основным при проведении реакции Чичибабина также с кетоном 22 и соединением 5.
Известно, что формиламины гидролизуются в щелочной или кислой среде с образованием аминов. Но наши неоднократные попытки гидролизовать соединение 23 и в кислой и в щелочной среде при кипячении (в спирте с 2н и 4н гидроксидом натрия, с добавкой серной, соляной, конц. уксусной кислот) до 6 часов к успеху не привели. Оно оказалось устойчивым и в неизменном виде выделялось из реакции.
3-азагексацикло[9.7.3.02,1.04,9.0 12,17]генэйкозан-12-ол (24).
В масс-спектре содержится пик молекулярного иона [М]+=303, а также пик иона [С13Н23N]+ с массой 193 единицы, соответствующий пергидроакридиновому фрагменту.
Рис. 12. Хроматограмма и масс-спектр соединения 24.
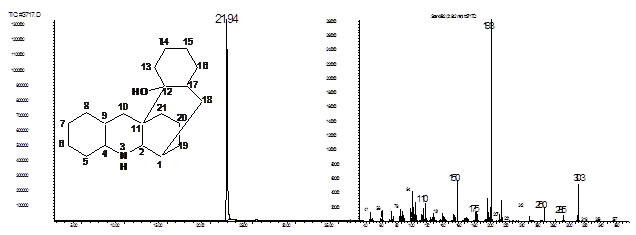 |
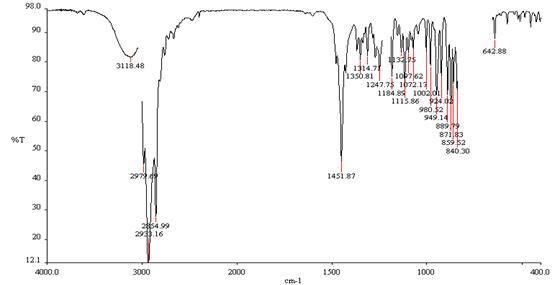
ИК спектр содержит широкую полосу поглощения при 3118 см-1. При снятии спектра с разбавлением картина не меняется, на основании чего мы считаем, что эта полоса соответствует NH-группе и связанной внутримолекулярной водородной связью ОН-группе.
Рис. 13. ИК спектр соединения 24 в CHCI3.
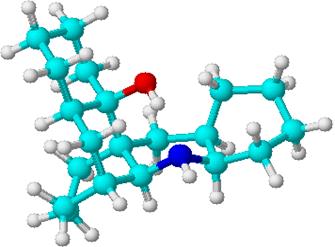
При помощи компьютерных расчетов нами была проведена 3D оптимизация (с использованием алгоритма CHARMM [29]). Группа –OH пространственно сближена с NH-группой и эмпирически рассчитанное расстояние между ними составляет 1,71 А. Это и приводит к прочной внутримолекулярной водородной связи.
В спектре ЯМР 1Н (d, м.д.) (рис. 14) содержится сигнал водорода при N-атоме при 6.83, исчезающий при снятии спектра с добавкой CD3OD.
В спектре ЯМР 13С (d, м.д.) (рис. 15) содержатся сигнал четвертичного углерода (С12), связанного с О-атомом при 76.56, двух третичных углеродов (С2, С4), связанных с N-атомом при 67.41 и 64.21, четвертичного углерода (С11) при 38.93, трех третичных С-атомов (С1, С9, С17) при 41.4, 40.1, 34.73.
Образование производного пергидроакридина 24 возможно из промежуточного продукта дециклизации – соединения 19 (схема 7):
Схема 7
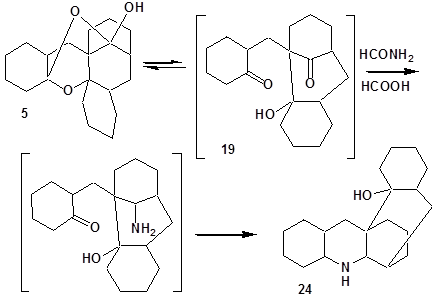
октадекагидро-2Н,6Н-хино[3,2,1-de]акридин (25).
Рис. 16. Хроматограмма и масс-спектр соединения 25.
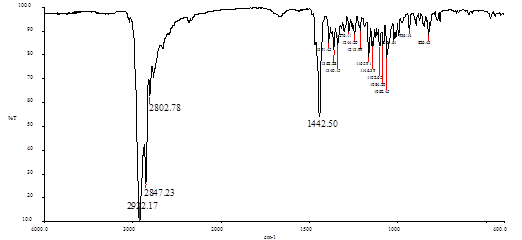
В ИК спектре отсутствуют полосы поглощения функциональных групп С=О, NH, OH.
Рис. 17. ИК спектр соединения 25 в КВr.
Индивидуального соединения 25 хватило на ГЖХ-МС, ИК-спектр и для определения Т.пл. Поэтому спектр ЯМР 13С был снят для смеси, состоящей из соединений 24 и 25 (1:1). И с учетом вычета уже известных характерных сигналов соединения 24, оставались сигналы, которые соответствовали предложенной структуре 25: сигналы третичных углеродов, связанных с азотом при 71.02 (С2) и при 70.90 (С6 и С11). Аналогично выглядит теоретически моделированный спектр для структуры 25 (рис. 18).
Образование соединения 25 из трикетона 2 представлено на схеме (8).
Схема 8
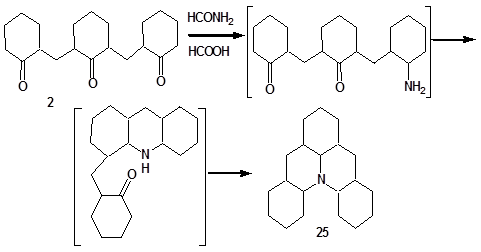
5. Реакция Чичибабина
При взаимодействии соединения 5 с ацетатом аммония в уксусной кислоте при нагревании в течение 1 часа основным продуктом реакции является продукт дегидратации 22. При нагревании реакционной смеси в течение
2-х часов основными продуктами реакции являются соединения 26 и 27.
Строение соединения 26 установлено на основании ГЖХ-МС, ИК и ЯМР 1Н, 13С-спектроскопии.
3-аза-22-гексацикло[9.7.3.14,12.04,902,11.012,17]генэйкозан-12-ол (26).
|
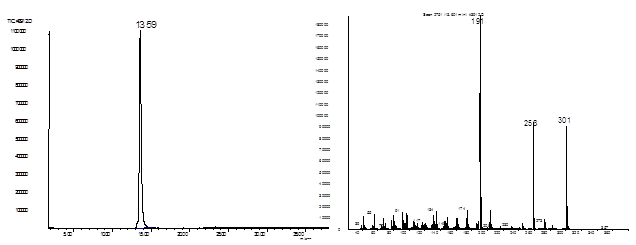 Рис. 19. Хроматограмма и масс-спектр соединения 26.
Рис. 19. Хроматограмма и масс-спектр соединения 26.
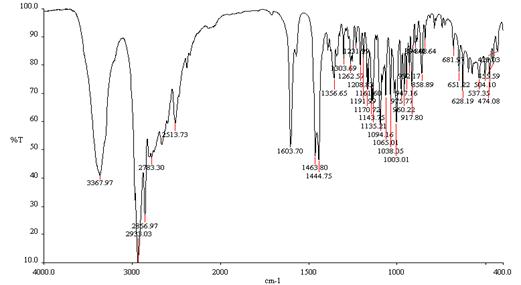
В ИК спектре содержится полоса поглощения аминогруппы (NH) в области 3368 см-1и деформационных колебаний связи C-N при 1603 см-1.
Рис. 20. ИК спектр соединения 26 в КВr.
В спектре ЯМР 1Н (d, м.д.) (рис. 21) содержится сигнал протона при N-атоме при 9.98, исчезающий при снятии спектра с добавкой CD3OD.
В спектре ЯМР 13С (d, м.д.) (рис. 22) содержатся сигнал четвертичного углерода (С4), связанного с N- и O-атомами при 83.99, четвертичного углерода (С12), связанного с O-атомом при 78.73, третичного углерода (С2), связанного с N-атомом при 58.94, сигналы трех третичных С-атомов (С1, С9, С17) при 41.44, 35.79 и 30.88, четвертичного углерода (С11) при 32.61.
В масс-спектре соединения 27 содержится пик молекулярного иона [М]+=297, а также пик иона [С13Н17N]+ с массой 187 единиц, соответствующий октагидроакридиновому фрагменту.
Рис. 23. Хроматограмма и масс-спектр соединения 27.