Основные химические законы и их использование в химической промышленности
![]() , где
, где
p-давление;
V-объем газа
Закон Бойля-Мариотта выполняется при очень малых давлениях
Закон Гей-Люссака
|
При постоянном давлении измене ние объема газа прямо пропорционально температуре. |
![]() , где
, где
T – абсолютная температура (К)
Закон объемных отношений
Первые количественные исследования реакций между газами принадлежат французскому ученому Ж. Г. Гей-Люссаку (1778-1850). Гей-Люссак, изучая взаимодействие газообразных веществ, вывел закон простых объемных отношений:
|
При одинаковых условиях (при неизменной температуре и давлении) объемы газов, вступающих, в реакцию, относятся друг к другу, а так же к объемам газообразных продуктов, как небольшие целые числа. |
Так, 1 объем водорода и 1 объем хлора дают 2 объема хлористого водорода. 2 объема водорода и 1 объем кислорода – 2 объема водяного пара, 3 объема водорода и 1 объем азота – 2 объема аммиака.
Одним из первых признал закон кратных отношений Гей-Люссака шведский химик Й. Я. Берцелиус (1779-1848), предположивший, что основное свойство газов заключается в том, что равные объемы газов при одинаковых условиях содержат одинаковое число атомов.
Закономерность, установленную Гей-Люссаком, невозможно было объяснить, руководствуясь учением Дальтона о том, что простые вещества состоят из атомов. В самом деле, если в равных объемах газов, например водорода и хлора, содержится одинаковое число атомов, то при их взаимодействии должен получиться один объем хлористого водорода, а не два, как показывал опыт.
Закон Гей-Люссака был объяснен итальянским физиком А. Авогадро (1776-1856).
Закон действующих масс
|
Скорость химической реакции пропорциональна концентрации регулирующих веществ. |
Для реакции
A+B=C+D
Закон действующих масс запишется следующим образом:
![]() , где CA и CB - концентрации вещества А и В (моль/л),
, где CA и CB - концентрации вещества А и В (моль/л),
k – коэффициент пропорциональности, константа скорости реакции, зависящая от природы реагирующих веществ и от температуры.
k=v, когда концентрации каждого их реагирующих равны 1 моль/л или их произведение равно единице.
Данное уравнение носит название кинетического уравнения реакции.
Концентрация твердого вещества в процессе химического превращения не меняется), процесс идет на поверхности), поэтому скорость в реакциях с участием твердого тела определяется только концентрацией газов или растворенных веществ.
В сложных (многостадийных реакциях) скорость всего процесса зависит от скорости наиболее медленной реакции.
Зависимость скорости реакции
Согласно правилу Фант-Гоффа, при повышении температуры на каждые 10°С скорость большинства реакций увеличивается в 2-4 раза. Число, показывающее, во сколько раз увеличивается скорость данной реакции при повышении температуры на 10°С, называется температурным коэффициентом реакции. Это правило является приближенным.
В 1889г. шведский ученый С. Аррениус предложил уравнение зависимости константы скорости реакции от температуры:
![]() , где
, где
k- константа скорости
A- постоянный коэффициент, характерный для каждой реакции,
R- универсальная газовая постоянная,
T- абсолютная температура,
Ea- энергия, названная Аррениусом энергией активации. Энергия активации измеряется в кДж/моль.
Реакционно-способными являются не все молекулы, а только активные, энергия которых в момент контакта составляет величину не меньшую Ea. В результате сообщения неактивным частицам вещества необходимой дополнительной энергии они превращаются в активные. Такой процесс носит название активации.
Энергия активации - это энергия, которую необходимо сообщить частицам реагентов для того, чтобы превратить их в активные. Энергия активации – это энергетический барьер реакции.
Затраченная на активацию молекул энергия выделяется полностью или частично при образовании продуктов реакции. Если при образовании продуктов реакции выделяется больше энергии, чем было необходимо для активации выделяется больше энергии, чем было необходимо для активации молекул, то такая реакция называется экзотермической, если меньше – то эндотермической. Для протекания эндотермических реакций необходимо подводить энергию из вне.
Закон Кюри
Пьер Кюри в 1895г. показал, что парамагнитная восприимчивость сильно зависит от температуры и для многих веществ обратно пропорциональна абсолютной температуре. Уравнение, выражающее эту зависимость,
![]() ,
,
![]() называют законом Кюри, а входящую в него величину называют мольной константой Кюри; D выражает диамагнитный вклад (он обычно отрицателен).
называют законом Кюри, а входящую в него величину называют мольной константой Кюри; D выражает диамагнитный вклад (он обычно отрицателен).
Первый член этого уравнения можно рассчитать на основе принципа Больцмана при допущении, что данное вещество содержит постоянные магнитные дипольные моменты, способные ориентироваться в магнитном поле. Такой теоретический расчет был выполнен французским ученым Полем Ланжевеном в 1905г. Он вывел уравнение
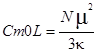 , где
, где
- ![]() величина дипольного магнитного момента в расчете на один атом или молекулу.
величина дипольного магнитного момента в расчете на один атом или молекулу.
Это уравнение позволяет рассчитать значения магнитных моментов по экспериментальной магнитной восприимчивости парамагнитных веществ, измеренной в некотором интервале температур. На основании полученных значений можно определить число не спаренных электронов в молекулах веществ.
Закон постоянства состава вещества
Закон постоянства состава был впервые сформулирован французским ученым Ж. Прустом в 1808г.
Современная формулировка закона такова:
|
Всякое чистое вещество независимо от способа его получения имеет постоянный качественный и количественный состав. |
Закон постоянства состава вещества вытекает из атомно-молекулярного учения. Вещества с молекулярной структурой состоят из одинаковых молекул, потому и состав таких веществ постоянен. При образовании из двух элементов нескольких соединений атомы этих элементов соединяются друг с другом в молекулы различного, но определенного состава. Например, азот с кислородом образует шесть соединений.
