Поверхностно-активные вещества
Вторая причина для развития этого направления заключается в необходимости устранения трудностей, связанных с пенообразованием или нежелательным образованием устойчивых эмульсий при использовании композиций ПАВ. По-видимому, использование ПАВ с лабильными связями позволит в какой-то мере решить эти проблемы. Если лабильная связь в молекуле ПАВ находится между полярной группой и гидрофобным радик
алом, разрыв этой связи приведет к образованию одного растворимого в воде продукта и второго — гидрофобного, не растворимого в воде. Очистку от обоих компонентов можно легко провести, пользуясь стандартными методиками. Этот подход особенно интересен в случае использования ПАВ в препаративной органической химии и во многих биохимических процессах.
В-третьих, перспективность использования ПАВ с ограниченной стабильностью заключается в возможности придания продуктам разложения новых полезных свойств. Например, поверхностно-активное вещество, входящее в состав композиций для личной гигиены, распадается с образованием продукта, полезного для ухода за кожей. Такие ПАВ иногда называют «функциональными» ПАВ.
Наконец, ПАВ, распадающиеся заданным образом на вещества, не обладающие поверхностной активностью, могут представлять интерес в специальных областях, например в биомедицине. Так, лабильные ПАВ, образующие везикулы или микроэмульсии, можно использовать при создании носителей для контролируемой доставки лекарственных веществ.
В большинстве случае лабильные ПАВ содержат в молекулах легко гидроли-зующиеся связи. Химический гидролиз катализируется кислотами или щелочами и достаточно хорошо изучен. В окружающей среде гидролиз лабильной связи происходит под действием ферментов, которые в этом случае выступают катализаторами процесса гидролиза. Следует сказать, что in vitro ферментативный гидролиз ПАВ с лабильными связями исследован далеко не полно. Существуют другие подходы, в которых для получения ПАВ с лабильными связями в молекулы включают связи, разрушающиеся под действием ультрафиолетового излучения или при озонировании. Ниже рассматриваются все указанные типы лабильных связей.
Лабильные ПAB, гидролизующиеся в кислой среде
Циклические ацетали
Лабильные ПАВ, производные циклических ацеталей — 1,3-диоксалана и 1,3-диоксана, представлены на рис. 8. Эти ПАВ гидролизуются в кислой среде. Их обычно синтезируют из длинноце-почечных альдегидов при взаимодействии с диолами или полиолами. Взаимодействие альдегидных групп с вицинальными гидроксигруппами приводит к образованию диоксолана, а взаимодействие с 1,3-диолами — к образованию диоксана.
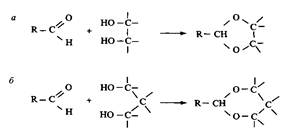
Рис. 8. Получение 1,3-диоксолановых и 1,3-диоксановых ПАВ из длинноцепочечных альдегидов и 1,2- и 1,3-диолов соответственно
Если реакцию проводить не с диолами, а с глицерином, образуется гидрокси-ацеталь. Соответственно модифицируя оставшуюся свободной гидроксильную группу, можно получить анионное или катионное ПАВ. В результате взаимодействия с глицерином образуется диоксолановое кольцо со свободной первичной гидроксильной группой, но может также образоваться и диоксановое кольцо со свободной вторичной группой. На свободные гидроксигруппы действуют SO3, нейтрализуют и получают сульфатное ПАВ; при обработке пропан-сультоном получают сульфонатное ПАВ. Гидроксильные группы можно заместить бромом или хлором, а затем по реакции с диметиламином получить катионное ПАВ с третичным амином в качестве полярной группы. Получение четвертичного аммония можно провести обычными способами, например реакцией с метилбромидом. Свободную гидроксильную группу можно также эток-силировать, при этом получится неионное ПАВ с лабильной группой. Скорость разложения таких неионных ПАВ в отстойниках очистной станции намного превышает скорость разложения обычных этоксилатов.
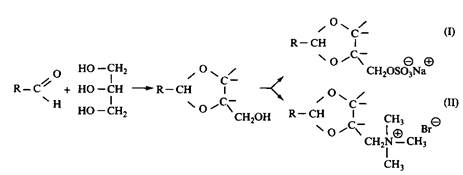
Рис. 9. Примеры 1,3-диоксоланоых ПАВ: — анионное ПАВ, — катионное ПАВ
В результате гидролиза циклические ацетали превращаются в альдегиды, которые являются промежуточными продуктами в процессе биохимического в-окисления углеводородных цепей. Кислотный гидролиз незамещенных ацеталей при комнатной температуре происходит довольно легко и с высокими скоростями при рН 4-5. Электроноакцепторные заместители типа гидроксильной группы, эфирного кислорода и галогенов замедляют скорость гидролиза. Анионные ацетальсодержащие ПАВ более лабильны, чем соответствующие катионные ПАВ. Этот результат можно объяснить высокой локальной активностью ионов гидроксония вокруг мицелл анионных ПАВ. Такой же эффект наблюдается и для ПАВ, образующих везикулы, вокруг которых активность ионов гидроксония повышается. Ацетальсодержащие ПАВ устойчивы в нейтральной среде и при высоких значениях рН.
1,3-Диоксолановое кольцо, как было установлено, приблизительно соответствует двум оксиэтиленовым единицам по влиянию на KKM и адсорбцию. ПАВ типа I подобны сульфатным эфирам с общей формулой R-20S03Na. Это очень интересно, поскольку промышленные сульфаты алкильных эфиров содержат две-три оксиэтильные группы.
Ациклические ацетали
Алкилглюкозиды, которые иногда ошибочно относят к алкилполиглюкозидам, представляют собой циклические соединения. Поскольку в этом случае геминальные гидроксильные группы гидратированного альдегида не входят в цикл, мы включаем их в группу ациклических ацеталей. Алкилглюкозиды — это самые важные представители ацетальсодержащих ПАВ.
Алкилглюкозидные ПАВ гидролизуются в кислых средах с образованием глюкозы и длинноцепочечного спирта. Они абсолютно устойчивы в щелочных средах даже при очень высоких значениях рН. Особенности расщепления таких ПАВ наряду с относительно простым синтезом делают их весьма привлекательными в составе чистящих композиций.
Расщепляющиеся ПАВ на основе полиэтиленоксида были синтезированы по реакции защищенных полиэтиленгликолей с длинноцепочечным альдегидом. В процессе кислотного гидролиза такие соединения распадаются на исходные вещества — алкилальдегид и защищенный ПЭГ. В результате исследований гидролиза было установлено соответствие между структурой и неустойчивостью соединений к гидролизу. Скорость гидролиза увеличивается с уменьшением длины гидрофобной части ПАВ при постоянстве полярной группы, что объясняется уменьшением гидрофобного экранирования ацетальной связи от ионов гидроксония. Варьирование полярных групп при постоянстве гидрофобной части не оказывает влияния на скорость гидролиза. Скорость гидролиза ацеталированного ПАВ также не зависит от структуры гидрофобной части. Скорость гидролиза свободных молекул ПАВ всегда выше, чем молекул, включенных в мицеллы.
Ацеталированные ПАВ по физико-химическим свойствам очень близки к обычным ПАВ. Однако значения KKM ацетальсодержащих ПАВ всегда немного ниже, чем KKM соответствующих обычных ПАВ. Кроме того, их эффективность, выраженная концентрацией, необходимой для снижения поверхностного натяжения на 20 мН/м, оказалась выше. Это безусловно указывает на то, что аце-тальные связи между гидрофобным радикалом и полярной группой дают определенный вклад в гидрофобность молекул ПАВ, повышая их поверхностную и адсорбционную активность на границе раствор-воздух, а также усиливают склонность к мицеллообразованию.
