Разработка энергохимико-технологической системы (ЭХТС)
Тепловая мощность химического реактора:
(мольные потоки – см. п. )
![]()
3.3 Баланс механической энергии
Допущения:
1. Газовые смеси подчиняются законам идеальных газов.
Параметры трубчатой печи
Число труб nтр=426 ; диаметр трубы dB=0,072м ; длина трубы LГ=42м
Диаметр зе
рна в зернистом слое dЗ=0,0027м
Баланс кинетической энергии: (второй закон)![]()
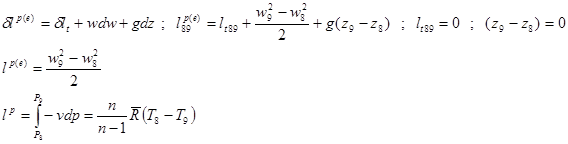
Баланс кинетической энергии записывается в виде:
![]()
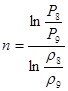
Давление P8 на входе в реактор ищем методом итераций: ![]()
Определяем величины, не изменяющиеся в ходе итераций:
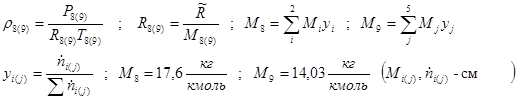
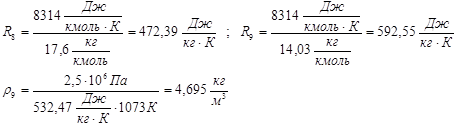
![]()
Массовый расход парогазовой смеси: ![]()
Сечение пучка труб
![]()
Скорость потока газов на выходе из реактора
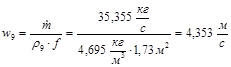
Потеря давления в реакторе происходит за счет трения и за счет местных сопротивлений.
![]() . ;
. ; ![]()
Коэффициент проницаемости зернистого слоя
![]()
Вязкость газовой смеси определяем как среднее арифметическое средних вязкостей на входе в реактор и выходе из него:
![]()
| Компонент |
|
|
|
|
|
|
CH4 | 13,4+0,019t | 300 | 19,2 | 0,2 | 20,06 |
| H2O | 8,3+0,040t | 300 | 20,5 | 0,8 | |
| CH4 | 13,4+0,019t | 800 | 30,5 | 0,0763 | 27,65 |
| H2O | 8,3+0,040t | 800 | 44,3 | 0,411 | |
| H2 | 9,5+0,014t |
800 | 22,1 | 0,43 |
![]()
Диссипация определяется из соотношения
![]()
Расчет давления P8 методом итераций
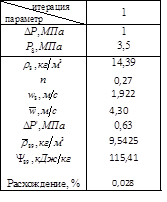
Т.о. ![]()
3.4 Эксергетический КПД процесса конверсии метана
![]()
![]()
![]()
![]() = 0,603
= 0,603
![]()
4. Технологический расчет и эксергетический анализ процесса горения
Исходные данные и допущения:
1. Процесс горения – адиабатный.
2. Процесс протекает изобарно при давлении 1атм (или близком к нему).
3. Исходные компоненты и продукты сгорания рассматриваются как идеальные газы.
4. Состав топлива (по объему): 0,5CH4 : 0,4C3H8.
5. Воздух, подаваемый в камеру сгорания, рассматривается как двухкомпонентная система с объемным соотношением компонентов
O2 : N2 = 21% : 79% = 1 : 3,76
6. Параметры топлива и воздуха на входе в камеру сгорания:
T1=Toc=T0=298,15K
P1=Poc=Pº=1 атм
7. Воздух, подаваемый в камеру сгорания, подается с избытком. Коэффициент избытка воздуха αизб=1,05
4.1 Материальный баланспроцесса горения
Уравнение реакции горения 1 моля топлива при полном сгорании топлива
0,4CH4 + 0,5C3H8 + 3,3αизбO2 +0,1N2+ 12,408 αизбN2→1,9CO2 + 2,8H2O + 3,3(αизб-1)O2 + (3,3*3,76αизб +0,1)N2
C учетом того, что αизб=1,01, уравнение реакции запишется в виде:
0,4CH4 + 0,5C3H8 + 3,465O2 +13,028N2+ 0,1N2 →
→1,9CO2 + 2,8H2O +0,165O2 + 13,128N2
![]()
4.2. Энергетический (энтальпийный) баланс
(Определение температуры адиабатного горения.)
Рассматриваемый процесс является стационарным процессом, совершающимся в открытой термодинамической системе. В этом случае энергетический баланс записывается в виде:
![]()
Полученное балансовое выражение является энтальпийным балансом:
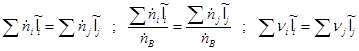
Энтальпия компонента на входе в камеру сгорания равна стандартной энтальпии образования ![]() ; на выходе – определяется из соотношения:
; на выходе – определяется из соотношения:
![]()
Энтальпии компонентов на входе в камеру сгорания.
| Компонент |
|
|
|
CH4 | -74,8 | 0,4 |
| С3H8 | -103,3 | 0,5 |
| O2 | 0 | |
|
N2 | 0 |
Другие рефераты на тему «Химия»:
- Получение экстракционной фосфорной кислоты
- Коллоидная химия
- Электрохимические методы анализа и их современное аппаратурное оформление - обзор WEB–сайтов фирм–продавцов химико-аналитического оборудования
- Закономерности процесса формования электродов на основе оксида меди и влияние параметров процесса на эксплуатационные характеристики литиевых источников тока
- Основные принципы подбора условий разделения
