Возможности экологического воспитания школьников при изучении темы: "Кальций и его соединения"
Тема «Кальций и его соединения» в школьном курсе химии
Химия – одна из стремительно развивающихся областей знания, результаты ее ускоренного развития в макро- и микромасштабах проявляются в повседневной жизни. А вот время на изучение этой дисциплины в школе неуклонно сокращается. И это не может не увеличивать пропасть между наукой и содержанием школьного предмета. Мы убеждены, что содержа
ние школьного курса химии и процесс обучения должны отражать не упрощенные представления об особенностях развития химической науки, а состояние современного знания, реальную сложность объекта познания химии.
Урок по теме «Кальций и его соединения» в 9-х классах средней общеобразовательной школы с. Карасу
Цель урока: познакомить учащихся с новым элементом – кальцием, ознакомить с его положением в периодической системе Д.И. Менделеева, рассмотреть важнейшие природные соединения и области их применения. Рассмотреть способы получения соединений кальция в промышленности, дать определение следующих понятий: жесткость воды, карбонатная и некарбонатная жесткость, изучить способы устранения жесткости воды.
Задачи обучения: сформировать представление об одном из биогенных элементов – кальции, расширить представление о способах получения, свойствах и способах получения и применения различных соединений кальция в промышленности.
Задачи развития: развитие у учащихся основных приемов мышления (умения анализировать, сравнивать и т.д.), совершенствовать умение учащихся самостоятельно работать с табличными данными и т.д.
Задачи воспитания: продолжить химическое образование школьников.
Ход урока
Организационный момент (1–2 мин.)
– посадка детей;
– проверка принадлежностей;
– отметка отсутствующих и т.д.
II. Опрос домашнего задания (10 мин.)
Вспомните, какое место занимает кальций в периодической системе Д.И. Менделеева?
Какую степень окисления проявляют кальций и магний? Почему?
Известна ли вам роль кальция в организме человека и живых существ?
III. Изучение нового материала (20 мин.)
1. Характеристика магния и кальция. Соединения кальция
Таблица 1. Схема строения атомов магния и кальция
|
Химический знак |
Размещение электронов по энергетическим уровням |
Электронная формула |
|
Mg |
+12 Mg 2e-, 8e-, 2e- |
1s2 / 2s22p6 / 3s2 |
|
Ca |
+20 Ca 2e-, 8e-, 8e-, 2e- |
…3s23p63d0 / 4s2 |
Положение магния и кальция в периодической системе и строение их атомов. Магний и кальций в периодической системе находятся в главной подгруппе группы. Схемы строения их атомов представлены в таблице. Как видно из схемы, последние два электрона у атомов магния и кальция расположены на наружном энергетическом уровне. Этим и объясняется, что магний и кальций во всех соединениях проявляют степень окисления +2.
2. Нахождение в природе.
Кальций обладает большой химической активностью, поэтому встречается в природе только в виде соединений (табл. 2).
|
Название минерала |
Химическая формула (основной составной части) |
Важнейшие месторождения |
|
Известняк, мрамор |
CaCO3 |
Широко распространен |
|
Гипс |
CaSO4 ∙ 2 H2O |
Широко распространен |
|
Фосфорит |
Ca3 (PO4) 2 CaCO3 ∙ MgCO3 |
Широко распространен |
3. Получение. Кальций получают путем электролиза его расплавленного хлорида.
4. Физические свойства. Кальций – металл серебристо-белого цвета, очень легкий (ρ = 1,55 г./см3), как и щелочные металлы, но несравненно тверже их и имеет гораздо более высокую температуру плавления, равную 851 0С.
5. Химические свойства. Подобно щелочным металлам кальций является сильным восстановителем, что схематически можно изобразить так:
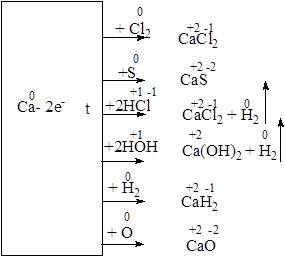
Соединения кальция окрашивают пламя в кирпично-красный цвет. Как и щелочные металлы, металлический кальций обычно хранят под слоем керосина.
6. Применение. Благодаря большой химической активности металлический кальций применяют для восстановления некоторых тугоплавких металлов (титан, цирконий и др.) из их оксидов. Кальций используют также в производстве стали и чугуна, для очистки последних от кислорода, серы и фосфора, для получения некоторых сплавов, в частности, свинцово-кальциевых, необходимых для изготовления подшипников.
7. Важнейшие соединения кальция, получаемые в промышленности.
Оксид кальция получают в промышленности обжигом известняка:
CaCO3 → CaO + CO2
Оксид кальция – тугоплавкое вещество белого цвета (плавится при температуре 2570 0С), обладает химическими свойствами, присущими основным оксидам активных металлов (I, табл. II, с. 88.
Реакция оксида кальция с водой протекает с выделением большого количества теплоты:
CaO + H2O ═ Ca (OH)2 + Q
Оксид кальция является основной составной частью негашеной извести, а гидроксид кальция – гашеной извести.
Реакция оксида кальция с водой называется гашением извести.
Оксид кальция применяется в основном для получения гашеной извести.
Гидроксид кальция Ca(OH)2 имеет большое практическое значение. Он применяется в виде гашеной извести, известкового молока и известковой воды.
Гашенная известь – тонкий рыхлый порошок, обычно серого цвета (составная часть гидроксида кальция), немного растворим в воде (1,56 г. растворяется в 1 л воды при 20 0С). Тестообразную смесь гашенной извести с цементом, водой и песком применяют в строительстве. Постепенно смесь твердеет:
Ca (OH)2 + CO2 → CaCO3 ↓ + H2O
Известковое молоко – взвесь (суспензия), похожая на молоко. Она образуется при смешивании избытка гашеной извести с водой. Применяют известковое молоко для получения хлорной извести, при производстве сахара, для приготовления смесей, необходимых в борьбе с болезнями растений, для побелки стволов деревьев.
Известковая вода – прозрачный раствор гидроксида кальция, получаемый при фильтровании известкового молока. Используют ее в лаборатории для обнаружения оксида углерода (IV):
Ca(OH)2 + CO2 → CaCO3 ↓ + H2O
При длительном пропускании оксида углерода (IV) раствор становится прозрачным:
Другие рефераты на тему «Педагогика»:
- Тема "Разрезы" в школьном курсе черчения и её влияние на развитие пространственного мышления
- Становление и развитие педагогики как науки в России
- Формирование ролевой игры у умственно отсталых детей дошкольного возраста
- Развитие устной и письменной речи учащихся на уроках русского языка как иностранного
- История западноевропейского образования
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
