Организация учебных экскурсий как средство формирования экологического мировоззрения и профориентации учащихся
3. Фильтрование.
Отфильтруйте с помощью воронки и фильтровальной бумаги 20-30 мл загрязненной воды в чистый лабораторный стакан. Проверьте отфильтрованную воду на загрязнение описанными выше способами.
Удаляются ли в результате фильтрования взвеси? Растворенные вещества? Бактерии? Сравните эффективность отстаивания и фильтрования.
4. Хлорирование.
Налейте 30-40 мл загрязненной в
оды в лабораторный стакан емкостью 100 мл. Добавьте несколько капель раствора хлорки, тщательно перемешайте и дайте отстояться в течение 10 мин. Проверьте воду на загрязнения.
Удаляются ли в результате хлорирования взвеси? Растворенные вещества? Бактерии? Почему в настоящее время особую актуальность приобретают разработки технологий обеззараживания волы без применения хлора?
4. Дистилляция.
Пронаблюдайте за процессом дистилляции воды.
Удаляются ли в результате дистилляции взвеси? Растворенные вещества? Бактерии? Почему дистилляцию не используют как единственный способ надежной очистки питьевой воды?
Проба с простейшими
Для опытов берут культуру простейших, приготовленную заранее.
а) Висячую каплю культуры простейших помещают над часовым стеклом с кашицей или вытяжкой исследуемого материала, чтобы они не соприкасались и, наблюдая в микроскоп при увеличении 300 или 600 (в зависимости от цели), отмечают по секундомеру время прекращения движения простейших.
Фитоцидную активность (А) выражают в единицах, рассчитанных по формуле, где Т - время.
А = 100: Т
Картина гибели простейших под влиянием фитонцидов разных растений различна. Это - растворение (лизис), образование вздутий и пузырей, сморщивание, просто прекращение движения и т.д.
б) В каплю культуральной жидкости с простейшими в середине часового стекла добавляют меньшую каплю вытяжки растений с сильной фитонцидной активностью. Наблюдают сначала усиление движения, затем избегание простейшими фитонцидной вытяжки (рассредоточение по краям), далее обнаруживаются уменьшение и вовсе прекращение движения.
Через некоторое время можно видеть и морфологические изменения, указанные в предыдущем разделе данной работы.
Для исключения растекания капли вытяжки ее место можно ограничить, сделав предварительно на предметном стекле петлю из человеческого волоса, в которую и помещают каплю культуральной жидкости.
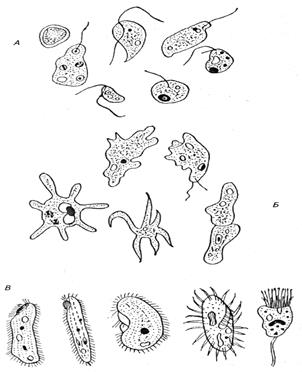
Простейшие - обитатели воды: А - жгутиковые, Б - амебы, В - инфузории [11].
3.3 Тестовые задания
Среди перечисленных веществ отметьте нерастворимое основание:
гидроксид бария;
гидроксид железа (II); +
гидроксид натрия;
гидрокарбонат аммония
Гидроксид цинка может реагировать со всеми веществами пары:
сульфат кальция и оксид серы (VI);
гидроксид натрия (р-р) и соляная кислота; +
вода и хлорид натрия;
сульфат бария и гидроксид железа (III).
В молекулярном уравнении реакции гидроксида цинка с соляной кислотой сумма всех коэффициентов равна:
1) 72) 5+3) 64) 4
Сумма коэффициентов в молекулярном уравнении реакций между гидроксидом алюминия и соляной кислотой равна:
1) 72) 8 +3) 64) 4
Формулы только основных оксидов указаны в ряду: 2O, SO2, CaO;
K2O, Na2O, CaO; +; CO, SO3, P2O5; CO, SO2, K2O.
Реакция
FeCl3 + 3NaOH ® Fe (OH) 3 + 3NaCl
относится к реакциям:
соединения;
разложения;
замещения;
обмена. +
При обычных условиях основания можно получить при взаимодействии с водой: BaO, CuO, FeO; Na2O, CaO, Li2O; +;MgO, ZnO, Al2O3; K2O, Li2O, Mn2O7.
Количеству вещества 1,5 моль равна масса гидроксида меди (II):
1) 98 г;
2) 196 г;
3) 147 г; +4) 980 г.
Реакции гидроксида железа (II) с серной кислотой отвечает сокращенное ионное уравнение:
FeO + 2H+ ® Fe2+ + H2O;
Fe (OH) 3 + 3H+ ® Fe3+ + 3H2O;
Fe (OH) 2 + 2H+ ® Fe2+ + 2H2O; +
Fe2+ + 2OH - ® Fe (OH) 2.
Основные свойства проявляет оксид:
марганца (VII);
кальция; +
калия; +
серы (IV), фосфора.
В схеме превращений:
![]()
веществами А, Б, В являются соответственно: Cl2, H2O, Na2O; HCl, NaOH, NaOH (избыток); +HCl, H2O, NaOH; Cl2, NaOH, Na2O.
Характер реакции среды водного раствора аммиака:
слабокислый;
сильнокислый;
нейтральный;
щелочной. +
Гидроксид алюминия проявляет амфотерные свойства при взаимодействии:
только с щелочью;
с кислотой и щелочью; +
только с кислотой;
с солью и кислотой
Раствор гидроксида натрия реагирует с каждым из веществ, указанных в паре:
оксид железа (II) и соляная кислота; +
хлорид железа (III) и углекислый газ;
серная кислота и оксид кальция;
оксид цинка и хлорид калия.
Конечным продуктом в цепочке превращений на основе цинка является:
![]()
гидроксид цинка;
оксид цинка; +
цинк;
цинкат калия
В сокращенном ионном уравнении реакции серной кислоты с гидроксидом натрия сумма коэффициентов равна:
1) 7;
2) 5;
3) 3; +4) 4.
Раствор гидроксида натрия взаимодействует с каждым веществом, указанным в ряду:
оксид кремния, сульфат натрия, хлоргидроксид алюминия;
оксид железа (II), медь, серная кислота, гидроксид алюминия;
оксид кремния, алюминий, соляная кислота, гидроксид цинка; +
оксид железа (II), медь, аммиак, гидроксид цинка.
В водном растворе ступенчато диссоциируют:
1) KOH;
2) Cu (OH) 2;
3) Ca (OH) 2; +4) Al (OH) 3.
Общая сумма всех коэффициентов в полном и сокращенном ионном уравнениях реакции между нитратом серебра и гидроксидом натрия равна (ответ напишите цифрами- 10)
Гидроксид бария можно получить из
BaO и H2CO3;
BaSO4 и NaOH;
BaO и NaOH
BaO и Н2О+
Установите соответствие:
|
Реагенты |
Протекает реакция |
|
1. Са (ОН) 2 ® (t) … 2. NaHCO3 + NaOH (p) ® … 3. Al2O3 + Na2O ® (t) … 4. Al + H2O ® … 5. (CuOH) NO3 + HNO3 ® … 6. PbCl2 + HI ® … |
А. Соединения (3) Б. Замещения (4) В. Разложения (1) Г. Нейтрализации Д. Ионного обмена (2, 5,6) |
Щелочь, а затем кислоту используют при осуществлении следующих превращений:
CaO ® CaCO3 ® CO2;
FeCl2 ® Fe (OH) 2 ® FeSO4; +
K ® KOH ® K2SO4;
CuSO4 ® Cu (OH) 2 ® CuO.
Сокращенным ионным уравнением Fe2+ + 2OH - = Fe (OH) 2¯ может быть выражено взаимодействие между:
FeO + KOH;
FeCl2 + NaOH; +
FeSO4 + Cu (OH) 2.
Сокращенным ионным уравнением NH4+ + OH - Û NH3 + H2O
можно выразить результат взаимодействия веществ:
хлорида аммония и гидроксида натрия; +
хлорида аммония и нитрата серебра;
аммиака и соляной кислоты;
сульфата аммония и гидроксида меди (II).
Другие рефераты на тему «Педагогика»:
- Методика формирования орфографической грамотности в начальной школе
- Состояние и перспективы развития общего образования в России
- Влияние коллектива на формирование личности младшего школьника
- Развитие мышления дошкольников с нарушением зрения
- Воспитание в современной школе: проблемы, достижения, инновации
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
