Организация химического эксперимента по органической химии в профильном классе
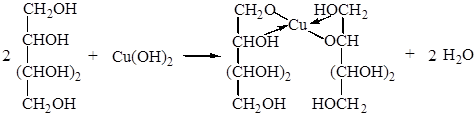
Опыт 6. Взаимодействие маннита со свежеосажденным гидроксидом меди (II).
Некоторые лекарственные средства (пиридоксин, аскорбиновая кислота, маннитол и другие) по своей химической природе являются многоатомными спиртами и содержат две и более гидроксильные группы в их молекулах. Поэтому весьма уместно на практическом за
нятии по химии использовать эти вещества для доказательства принадлежности их к многоатомным спиртам. Так маннитол (или просто маннит) – шестиатомный спирт, формула которого С6Н14О6, или СН2ОН(СНОН)4СН2ОН. Применяется как эффективное диуретическое средство. Продается в аптеках в виде 15%-ного раствора по 200, 400, 500 мл. Устойчив при хранении (хранится более двух лет). Раствор маннита объемом 2-3 мл приливают к свежеприготовленному голубому осадку гидроксида меди (II), осадок растворяется с образованием ярко-синего раствора. Уравнение реакции аналогично уравнению реакции взаимодействия ксилита с Сu(ОН)2.
Описанный химический эксперимент по теме «Многоатомные спирты» базируется на использовании веществ, широко распространенных в природе и применяемых человеком в хозяйственной деятельности и повседневной жизни. Такой подход позволяет тесно связать процесс обучения химии с познанием окружающей действительности и усилить интерес учащихся к этой теме.
Химический эксперимент по теме «Карбоновые кислоты».
Концепция профильного образования требует усиления экспериментальной направленности обучения дисциплинам естественного цикла, в том числе и химии в классах соответствующего профиля. И здесь как никогда важна связь процесса обучения химии в школе с окружающей нас действительностью. Учащиеся не только должны получить глубокие знания о строении и свойствах химических веществ, но и иметь определенные представления об их роли в природе и жизни человека, выработать реальные навыки обращения с химическими веществами. И здесь учителю представляется широкая возможность использования для проведения химического эксперимента весьма доступных из природных источников и известных из повседневной жизни веществ. Такой подход к проведению лабораторных и практических занятий не только не ослабит интереса учащихся к изучаемой дисциплине, а, наоборот, усилит его.
В этом отношении следует отметить удачные методические находки в проведении школьного химического эксперимента по органической химии, предложенные Храмовым В.А. с соавторами (см. «Химия в школе», 2005-06 гг). Однако они далеки от школьной программы и, скорее всего, их можно рекомендовать для проведения элективных курсов по химии или для работы научного общества учащихся (НОУ) по химии.
В связи со сказанным предлагается свой опыт проведения химического эксперимента по органической химии на примере изучения темы «Карбоновые кислоты» в классах с углубленным изучением химии.
1. Диссоциация карбоновых кислот. Для этого используется раствор уксусной кислоты, приготовленный 10-кратным разбавлением 70%-ного столового уксуса. Берут три пробирки с раствором уксусной кислоты. В одну из них опускают универсальный лакмус, в другую добавляют раствор метилового оранжевого, а в третью – водный экстракт калины (он выступает в качестве природного индикатора, и этот вывод учащиеся делают сами на основании результатов проведенных испытаний).
Во всех случаях растворы уксусной кислоты приобретают красное окрашивание, что указывает на кислую реакцию среды:
![]()
2. Взаимодействие карбоновых кислот с металлами. Опыты проводят с раствором уксусной кислоты. Для этого в три пробирки наливают по 2-3 мл раствора уксусной кислоты, в одну из них бросают кусочек цинка, в другую – кусочек алюминиевой проволоки (проволоку желательно предварительно почистить наждачной бумагой), а в третью – кусочек медной проволоки. В первых двух пробирках наблюдают выделение газа, в третьей – нет никаких изменений.
Учащиеся делают вывод о сходстве карбоновых кислот с неорганическими кислотами, сравнивают скорость реакций (по интенсивности выделения водорода) цинка и алюминия с раствором уксусной кислоты, связывая это с активностью металлов.
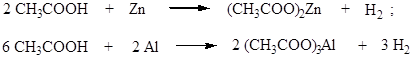
3. Взаимодействие карбоновых кислот с оксидами металлов. Демонстрируют реакцию раствора уксусной кислоты с оксидом меди (II), который можно приготовить прокаливанием медной проволоки в пламени газовой горелки или обычной спиртовки.
Черный оксид меди (II) реагирует с уксусной кислотой при нагревании с образованием раствора ацетата меди голубого цвета:
![]()
4. Взаимодействие карбоновых кислот с основаниями. В раствор уксусной кислоты добавляют немного ржавчины (ее заранее можно приготовить, поместив небольшой железный гвоздь во влажное полотно или в обычный химический стакан с водой). Ржавчина, как известно, – это слой частично гидратированных оксидов железа, в ее состав входит и гидроксид железа (III). При умеренном нагревании он реагирует с уксусной кислотой с образованием раствора ацетата железа красно-оранжевого цвета, который затем при кипячении в течение 3-5 минут вследствие гидролиза превращается в основный ацетат железа, выпадающий в осадок в виде красно-бурых хлопьев:
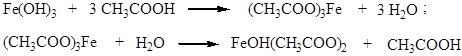
5. Взаимодействие карбоновых кислот с солями. Можно использовать золу растений (в ней содержится кроме прочего карбонат калия), пищевую соду (гидрокарбонат натрия), школьный мел или кусочки известняка или мрамора (карбонат кальция). Во всех случаях уксусная кислота вытеснит угольную кислоту из ее солей. Выделяющийся газ можно идентифицировать как углекислый газ, например:
![]()
6. Непредельный характер некоторых кислот. Непредельные кислоты можно приготовить из обычного растительного масла. Для этого его надо прокипятить 2-3 мин. с водным раствором соды (карбоната натрия) или поташа (карбоната калия, из золы растений). Если раствор получится окрашенным, его можно обесцветить активированным углем (уголь можно также заранее приготовить с ребятами или использовать аптечный препарат), а затем отфильтровать. В две пробирки помещают приготовленный раствор непредельной (олеиновой) кислоты, в одну добавляют несколько капель йода (аптечный спиртовой раствор), а в другую – разбавленный раствор перманганата калия (аптечной марганцовки). В обоих случаях произойдет обесцвечивание растворов реагентов. Кроме того, во второй пробирке появится бурый осадок диоксида марганца:
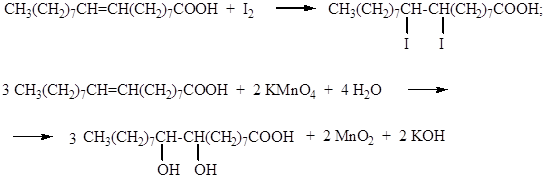
7. Особые свойства муравьиной кислоты. Используется водный раствор муравьиной кислоты и водный экстракт выделений муравьев. Оба раствора делят пополам. К одной части этих растворов добавляют аммиачный раствор оксида серебра, нагревают и наблюдают появление черного осадка металлического серебра (может образоваться серебряное зеркало). К другой части этих растворов добавляют слабо розовый перманганат калия: наблюдается обесцвечивание и образование бурого осадка диоксида марганца:
Другие рефераты на тему «Педагогика»:
- Процесс формирования основ здорового образа жизни у дошкольников
- Особенности формирования школьного коллектива в начальной школе
- Структурное единство интеллекта и пути развития его у школьников начальной школы
- Проблемы обучения детей на занятиях в условиях разновозрастной группы
- Образовательный сервис в Финляндии
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
