Характеристика основных факторов и методов мотивации персонала, и установление их влияния на работу коллектива отдельного предприятия
![]() , кг/м3 [6 с-13];
, кг/м3 [6 с-13];
Р – давление, Па;
М – молекулярная масса, кг/моль;
R – универсальная газовая постоянная;
T – температура, К;
Р = 20*105Па;
М = 28*10-3кг/моль;
R = 8,314 Дж/(кмоль*К);
T = 308 К;
![]() кг/м3;
кг/м3;
4 src="images/referats/23927/image014.png">шт.;
Для производства полиэтилена марки 276 необходим один реактор.
Определим необходимое количество питателей для катализатора.
Q =0,053;
ссм = скат-ра = 320 кг/м3;
Va = 0.8 м3;
ц = 0,95;
Подставляем необходимые значения в формулу и определяем количество питателей для катализатора.
![]() шт.;
шт.;
Для производства полиэтилена марки 276 необходимо два питателя для катализатора.
Определим необходимое количество емкостей для выгрузки продукта по формуле подставив туда необходимые данные.
Q = 0,85;
ссм = сПЭ = 963 кг/м3;
Va = 4,2 м3;
ц = 0,95;
![]() шт.;
шт.;
Для производства полиэтилена марки 276 необходимо две емкости для выгрузки продукта.
2.7 Тепловой расчет [7]
Цель: Определить количество подводимого тепла, а также рассчитать необходимую поверхность теплообмена холодильника.
Исходные данные для расчета:
Количество исходных газов (этилен и бутен-1), поступающих в реактор складывается из следующих значений: mэт = 260000 кг/ч = 72,22 кг/с и mбут = 6240 кг/ч = 1,73 кг/с, количество их на выходе из реактора с учетом пошедших газов на получение полиэтилена (см. материальный баланс):
mэт = 65,50 кг/с; mбут = 1,597 кг/с.
Тепловой баланс процесса полимеризации имеет следующий вид:
Q1 = Q2 + Q3 + Qпот – Q4 ,
где Q1– количество тепла, подводимое с циркуляционным газом, кДж/с;
Q2– количество тепла, уходящее с полиэтиленом при выгрузке, кДж/с;
Q3– количество тепла, уносимое с циркуляционным газом, кДж/с;
Q4 – тепловой эффект реакции, кДж/с;
Qпот – потери тепла в окружающую среду, кДж/с.
Количество тепла, приходящее с циркуляционным газом, определяется формуле:
Q1 = ∑Gi•Ci•tЦГ ,
где Gi - секундный расход газов, входящих в циркуляционный газ:
Gэт = 72,22кг/с – секундный расход этилена;
Gбут = 1,73кг/с – секундный расход бутена-1;
Ci – теплоемкость газов:
Сэт = 1,92 кДж/кг•град – этилена;
Сбут = 1,90 кДж/кг•град – бутена-1;
tЦГ = 363 К – температура циркуляционного газа на входе в реактор.
Количество тепла, приходящее с этиленом:
Q3 эт = 72,22• 1,92 •363 = 50334,45 кДж/сек,
с бутеном: Q3 бут-1 = 1,73• 1,90• 363 = 1193,20 кДж/сек
Всего газом приходит:
Q3 = Q3 эт + Q3 бут-1 = 51527,63 кДж/сек
Количество тепла, уходящего в окружающую среду Qпот принимаем равным 3% от теплового эффекта реакции [6]:
Qпот =3% • Q4
Тогда тепловой баланс приобретает следующий вид:
Q1 = Q2 + Q3 – 0,97Q4
Тепловой эффект реакции определяется по формуле [8]:
Q4 = Gпэ •qР ,
где Gпэ = 6,85кг/сек – секундная производительность по полиэтилену;
qР = 345 кДж/кг – тепловой эффект реакции полимеризации [2].
Q4 = 6,85•345 = 2363,25 кДж/с
Qпот = 0,03 •2363,25 = 70, 9 кДж/сек
Количество тепла, уходящее с полиэтиленом при выгрузке определяется [4], пренебрегая количеством тепла, уносимым порошком вместе с газом, т.к. его количество очень мало:
Q2 = Gпэ•Cпэ•tпэ ,
где Gпэ = 6,85 кг/с – секундная производительность по полиэтилену;
Cпэ = 2,01 кДж/кг•град – теплоемкость порошка полиэтилена [9];
tпэ – температура выгружаемого порошка полиэтилена
Q2 = 6,85•2,01•373 = 5135,65 кДж/с.
Количество тепла, уносимое с циркуляционным газом, также определяется формулой:
Q3 = ∑Gi•Ci•tЦГ ,
где Gi - секундный расход газов, входящих в циркуляционный газ:
Gэт = 65,50 кг/с – секундный расход этилена;
Gбут = 1,597 кг/с – секундный расход бутена-1;
Ci – теплоемкость газов:
Сэт = 1,92 кДж/кг•град – этилена;
Сбут = 1,90 кДж/кг•град – бутена-1;
tЦГ = 378 К – температура циркуляционного газа при выходе из реактора.
Количество тепла, уносимое с этиленом:
Q3 эт = 65,497• 1,92 •378 = 47535,21 кДж/с,
с бутеном:
Q3 бут-1 = 1,60• 1,90• 378 = 1149,12 кДж/с
Всего газом уносится:
Q3 = Q3 эт + Q3 бут-1 = 48684,33 кДж/с.
Полученные данные подставим в уравнение теплового баланса:
Q1 = Q2 + Q3 – 0,97Q4
Q1 = 5135,65 + 48684,33 – 0,97• 2363,25 = 51527,63 кДж/с,
что подтверждает выполнение равенства.
Правильность выполнение теплового баланса подтверждается результатами таблицы теплового баланса
Таблица 2.6
Сводная таблица теплового баланса
| Приход | Расход | ||
|
Наименование тепловых потоков | Количество, кДж/с |
Наименование тепловых потоков | Количество, кДж/с |
|
Тепло с циркуляционным газом | 51527,63 |
Тепло с полимером | 5135,65 |
|
Тепловой эффект реакции | 2363,25 |
Тепло с циркуляционным газом | 48684,33 |
|
Потери тепла | 70,9 | ||
|
Итого: | 53890,88 |
Итого: | 53890,88 |
Тепловой расчет теплообменника
Исходные данные к расчету:
t1= 373К – температура воде на входе в теплообменник;
t2 – температура на выходе из теплообменника;
t3 = 293К – температура умягченной воды в нормальных условиях;
дст = 3 мм – толщина стенки трубки;
лст = 17,5 Вт/(м•К) – коэффициент теплопроводности трубок.
Рассчитаем температуру циркуляционного газа:
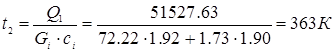
Коэффициент теплопередачи:
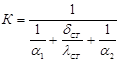 ,
,
где б1 – коэффициент теплоотдачи от этилена стенкам, Вт/(м2•К)
б2 – коэффициент теплоотдачи от стенок воде, Вт/(м2•К).
Определение режима течения воды осуществляем по формуле:
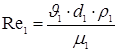 ,
,
где d1= 0,025 м – наружный диаметр трубы;
н1 = 1 м/сек – скорость воды;
с1 = 998 кг/м3 –плотность воды;
