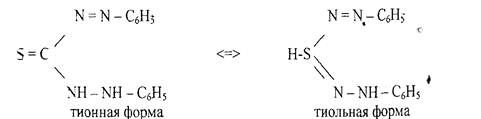Качественный анализ (кислотно-основная классификация)
Качественные реакции катионов Hg2+.
1.Реакция с соляной кислотой и хлорид - ионами.
Hg22+ + 2СГ = HgCI2 (каломель - бел. постепенно чернеет с выделением тонкодисперсной металлической ртути:
Hg2Cl2 = HgCl2 + Hg., p.- в HNO3 алогично при действии аммиака:
Hg2Cl2 + 2 NH4OH = [NH2Hg]Cl | + Hg + NH4C1 + 2 H2O)
2.Восстановление Hgf~ до металлической ртути хлоридом олова (II
).
Hg2(NO3)2 + SnCI2 = Hg2Cl21 (каломель - бел. постепенно чернеет) + Sn(NO3)2 Hg2Cl2 + SnCb = 2Hg + SnCl4
3.Восстановление Hg}'' металлической медью.
Hg22+ + Си -=2Hg + Cu2+
4.Реакция с водным раствором аммиака.
2Hg2(NO3)2 + 4 NH3 + Н2О = [OHg2NH2]NO3 1 (черн.) + 2Hg +3NH4NO3.
Реакциясо щелочами.
Hg22+ + 2ОН' = Hg2O |(черн, р.- в HNO3 конци конц. уксусн. к-те) + Н20
Реакция с йодидами
Hg2(N03)o +2KI = Hg2l2j (желто-зелен., в изб. KI переходит в черный) 2KNO,
Hg2I2 +2I- =[Hgl4]2- + Hg.
7. Реакция с хромат - ионами.
Hg22+ + CrO42- = Hg2Cr04 | (красный, р.- в HNO3)
Качественные реакции катионов Рb2+
1. Реакция с хлорид - ионами.
Рb 2+ + 2Сl- = РbСl2 (бел., р.- при нагревании с водой, при охлажде опять n | )
2. Реакция с йодид - ионами (реакция -золотого дождя-)
Рb2++ 2I- = Рb21 (при охлаждении желтые чешуйчатые кристаллы, р- в изб КI)
3. Реакции с хромат и дихромат ионами
Рb 2+ + Cr2O72- = Рb CrO4 (желтый)
4. Реакции с сульфат ионами
Рb 2+ + SO42- = Рb SO4 (белый осадок)
Проведению реакции мешают катионы образующие мало растворимые сульфаты (Ca, Sr, Ba, Hg)
5. Реакции с сульфид-ионами
Pb2+ + S2- = Pb S (осадок, черн., р-в в HNO3)
6. Реакции с родизонатом натрия Na2C6O6
Катионы свинца образуют с родизонатом Na окрашенный комплекс синего цвета (Pb3(C6O6)2(ОН)2), который в слабокислой среде (рН = 2,8) изменяет окраску.
Аналитические реакции катионов Ш группы: Са2+, Sr2+, Ва2+
Групповой реагент –Н2SО4
Качественные реакции катионов Са2+
1. Реакция с сульфат – ионами
Са2+ + SО42- + 2Н2О = СаSО4 2Н2О (белые игольчатые кристаллы)
Осадок нерастворим в кислотах и щелочах, но растворяется:
А) в насыщенном водном растворе сульфата аммония с образованием комплекса (NH4[Са(SО4)2]), что позволяет определить Са2+от Sr2+и Ва2+;
CaSO4 + (NH4)2SO4=(NH4)2[Ca(SO4)2]
В растворе соды (Na2CO3) белыйосадок сульфата кальция переходит в белый осадоккарбоната кальция, который вдальнейшем растворяется в кислотах.
2. Реакции с оксилатом аммония (фармокопейная)
Са2+ + С2О42- = Са С2О4
Осадок нерастворим в растере аммиака, но растворяется в разбавленных минеральных кислотах с образованием щавелевой кислоты-
3 Реакция с углекислый натрием (Na2CO3)
Са2+ + Na2CO3 = Са CO3 (белый)+ NH4
Осадок СаСО3 легко растворяется в минеральных и уксусной кислотах.
4. Реакция с гексацианоферратом (II) калия
Са2+ + 2NH4+ + [Fe(CN)6]4-= (NH4)2Ca[Fe(CN)6]
Выпадает белый кристаллический осадок, который не растворяется в уксусной кислоте
5.Реакция с гидрофосфатом натрия (Na 2НРО4)
Са2+ +НРО42- = Са НРО4(белый)
6. Реакция с родзинатом натрия
Na2C6O6 + 2 Са2+ + 2 ОН-= Са C6O6(ОН)2 + 2Na+ (фиолетовый, растворим в НС1)
7. Окрашивание пламени (фармакопейный тест)
Соли и другие соединения кальция окрашивают бесцветное пламя горелки в кирпично-красный цвет.
Качественные реакции катионов Sr2+
1. Реакция с серной кислотой и растворимыми сульфатами.
Sr2+ + SO42- = SrSO4| (белый кристаллический)
а). Реакция с -гипсовой водой-. Выделяется белый осадок SrSO4.
б) Реакция с серной кислотой. Выпадает белый кристаллический осадок SrSO4, который нерастворим в щелочах, в растворе сульфата аммония (в отличии от сульфата кальция). Мешают катионы Ва2+
2. Реакция с карбонат – ионами
Sr2+ + СO32- = SrСO3 (белый кристалический), растворимый в кислотах.
3. Реакция с оксалатом аммония.
Sr2+ + С2О42- = SrC2O4 1 (белый) Осадок частично растворяется в уксусной кислоте.
4. Реакция с гидрофосфатом натрия (Na2HPO4).
Sr2+ + НРО42- = SrHPO41 (белый)
Осадок растворяется в минеральных и уксусной кислотах.
5. Реакция с родизонатом натрия.
Sr2+ + Na2C6O6 = SrC6O6 (красно-бурый, растворим в НС1)+ 2 Na+
Образование красно-бурого пятна. В растворе НС1 окраска пятна исчезает.
6. Окрашивание пламени газовой горелки.
Соли стронция при внесении в бесцветное пламя горелки окрашивают пламя в карминово-красный цвет.
Качественные реакции катионов Ва2+
1. Реакция с серной кислотой и растворимыми сульфатами.
Ва2+ + SO42- = BaSO4 (белый мелкокристаллический)
Осадок нерастворим в щелочах и кислотах, за исключением концентрированной H2SO4, в которой он заметно растворяется с образованием гидросульфата бария:
BaSO4 + H2SO4 -> Ba(HSO4)2.
При нагревании с раствором карбонатов (Na2CO3) сульфат бария превращается в мало растворимый в Н2О карбонат бария ВаСОз, который растворяется в кислотах. Мешают проведению реакции Са2+, Sr2+, Pb2+.
2. Реакции с углекислым натрием, гидрофосфатом натрия и оксалатом аммония (Na2CO3, Na2HPO4, (NH4)2C2O4). Выпадают белые осадки, растворимые в соляной, азотной и уксусной кислотах (ВаС2О4 - при нагревании).
3. Реакция с родизонатом натрия.
в нейтр. среде:
Ва2+ + Na2C6O6 = ВаС6Об 1+2 Na+ (красно-бур.)
в кисл. среде:
Ва2+ + 2 Na2C6O6 + 2 Н+ = Ва(НС6О6)2 + 4 Na+ (ярко красн.)
4. Реакция с хроматом и дихроматом калия.
Ва2+ + СгО42- = Ва СгО 4 (желтый кристаллический)
2 Ва2+ + Сг,О72- + 2 СН3СОО- + НОН = 2 ВаСгО4 + 2 CH3COOН
Растворяется в сильн. кислотах (кроме H2SO4), не растворяется в уксусной кислоте.
5. Окрашивание пламени горелки.
Соли и другие соединения бария окрашивают бесцветное пламя горелки в желто-зеленый цвет.
Аналитические реакции катионов IV аналитической группы по кислотно-основной классификации: Zn2+, Al3+, Sn2+, Sn4+, As3+, As5+, Cr3+
Групповой реагент - гидроксид натрия или калия в присутствии Н2О2
Аналитические реакции катиона цинка Zn2+
1. Реакция с щелочами:
Zn2+ + 2 ОН- = Zn(OH)2 (белый)
Zn(OH)2 + 2 ОН- =• [Zn(OH)4]2- (бесцветный)
2. Реакция с раствором аммиака:
Zn2+ + 2 NH3-H2O —► Zn(OH)2 (белый) + 2 NH4+ Zn(OH)2 + 4 NH3 — [Zn(NH3)4] (OH)2 (бесцветный)
Осадок нерастворим в разбавленной НС1, растворяется в щелочах.
3. Реакции с сульфид-ионами (фармакопейная):
Zn2+ + S2- = Zn S (белый)
Реакцию часто проводят в уксусной среде.
4. Реакция с гексацианоферратом (II) калия (фармакопейная)
Реакцию проводят в нейтральной или слабокислой среде, при нагревании
2 К+ + 3 Zn2+ + [Fe(CN)6]4-= К2 Zn3[Fe(CN)6]2 (белый)
Осадок нерастворим в разбавленной НСl, растворяется в щелочах
5. Реакция с литизоном (дифенилтиокарбазоном). В растворах дитизона
устанавливается таутомерное равновесие между тионной и тиольной формами: