Одноосновные насыщенные карбоновые кислоты
![]()
 Энергия
Энергия
| > | |||
 | |||
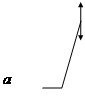 | |||
![]() RCOOH + :B « RCOO- + +BH
RCOOH + :B « RCOO- + +BH
координата реакции
Энергия а - стабилизация, вызванная делокализацией в RCOOH; b - стабилизация, обусловленная делокализацией в RCO-; 1 - гипотетическая кривая, делокализация отсутствует; 2 - истинная кривая, имеется делокализация.
Кислотность выражают количественно через константу кислотности (называемую также константой диссоциации) Ка или через рКа:
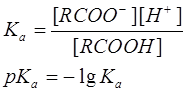
Константы кислотности большинства карбоновых кислот составляют около 10-5 (например, для уксусной кислоты 1,8×10-5), что свидетельствует о довольно высокой концентрации неионизированной формы кислоты. Поэтому большая часть карбоновых кислот относится к слабым кислотам. Кислотность больше для тех кислот, в молекуле которых имеется заместитель, стабилизирующий карбоксилат-ион. К таким заместителям относятся галогены и прочие электроотрицательные группы. Влияние заместителей на кислотность показано в Таблице.
|
Кислота |
рКа |
|
CH3COOH |
4,8 |
|
ClCH2COOH |
2,9 |
|
Cl2CHCOOH |
1,3 |
|
Cl3CCOOH |
0,7 |
|
FCH2COOH |
2,6 |
|
CH3CH2CH2COOH |
4,8 |
|
F3CCOOH |
0,2 |
1. Образование солей
Органические кислоты образуют соли с металлами, их оксидами, карбонатами, гидрокарбонатами и щелочами, например:
CH3COOH + NaOH ® CH3COONa + H2O
2. Образование галогенангидридов
Под действием галогенидов фосфора карбоновые кислоты образуют ангидриды (гидроксил замещается на галоген):
CH3COOH + PCl5 ® CH3COCl + POCl3 + HCl
Хлорангидриды могут также быть получены действием на карбоновые кислоты тионилхлорида:
CH3COOH + SOCl2 ® CH3COCl + SO2 + HCl
3. Восстановление
Карбоновые кислоты можно восстановить только с помощью очень сильных восстановителей, поэтому в качестве продуктов реакции всегда образуются первичные спирты (а не альдегиды):
CH3COOH + LiAlH4 ® CH3CH2OH
4. Декарбоксилирование
Карбоновые кислоты очень легко теряют диоксид углерода. Как правило, при этом образуется углеводород. Алифатические карбоновые кислоты декарбоксилируют в присутствии различных катализаторов, содержащих медь. CH3CH2COOH ® CH3CH3 + CO2.
К реакциям декарбоксилирования относится и синтез Кольбе (см. Лекцию №2).
5. Этерификация
В присутствии сильной кислоты (например, серной) карбоновые кислоты дают со спиртами сложные эфиры:
CH3COOH + CH3CH2OH « CH3COOCH2CH3 + H2O
В результате реакции образуется равновесная смесь. Чтобы сместить равновесие в сторону образования продукта, используют большой избыток спирта или удаляют воду по мере ее образования.
Механизм этерификации представляет собой реакцию присоединения – отщепления (нуклеофильное ацильное замещение) Протон, являющийся катализатором, облегчает атаку карбонильной группы нуклеофилом:
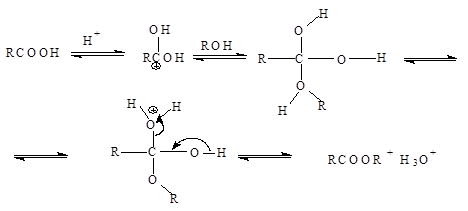
Отдельные представители
Муравьиная кислота. Получают из ее натриевой соли (формиата), которая образуется при пропускании оксида углерода через 25-30% раствор щелочи:
NaOH + CO ® HCOONa
Суспензию формиата натрия затем разлагают муравьиной кислотой.
Муравьиная кислота применяется для приготовления катализаторов, в медицине и в ряде синтезов. Из ее производных наибольшее значение имеет N,N-диметилформамид HCON(CH3)2. Он является селективным растворителем при выделении ацетилена из газовых смесей и при абсорбции HCl, SO2, CO2 и некоторых других газов.
Муравьиная кислота обладает многими химическими свойствами кислот, но ей присущи и некоторые специфические особенности:
1. является хорошим восстановителем (легко окисляется):
HCOOH + HgCl2 ® Hg + CO2 + 2 HCl
Восстановительные свойства муравьиной кислоты объясняются тем, что она в одно и то же время является кислотой и оксиальдегидом, что видно из ее формулы.
2. при нагревании с концентрированной H2SO4 распадается с образованием воды и СО:
HCOOH ® H2O + CO
3. соли щелочных металлов при сплавлении распадаются с образованием солей щавелевой кислоты (оксалаты):
2 HCOONa ® H2 + NaOOC-COONa
Уксусная кислота. Широко применяется для получения сложных эфиров, уксусного ангидрида, винилацетата, а также в производстве красителей, лекарственных и душистых веществ. Большое практическое значение имеют и соли уксусной кислоты - натрия, алюминия, хрома, железа, меди, свинца и др. В промышленности уксусная кислота получается рядом способов:
1. окисление алканов;
2. окисление этанола;
3. гидратация ацетилена и окисление получаемого ацетальдегида;
4. уксуснокислое брожение сахарсодержащих растворов.
