Подгруппа углерода
а) Вытеснение водорода металлами из кислот
Оборудование и реактивы: 5 пробирок, штатив для пробирок, шпатель, раствор соляной кислоты (1:3); металлы: магний, алюминий, железо, медь, цинк. Все металлы в виде порошка.
Ход работы: Берут пять пробирок с раствором соляной кислоты и в каждую из них помещают порошки цинка, магния, алюминия, железа и меди в равных порциях. В первых четырех проб
ирках идет интенсивное выделение водорода (интенсивность выделения уменьшается от магния к железу). В пробирке с медью выделение водорода не происходит. Написать соответствующие уравнения реакций. Объяснить, почему реакция с алюминием идет вначале очень медленно.
Утилизация. Во все пробирки добавить при полном растворении в них указанных металлов соответствующие оксиды или гидроксиды в небольшом избытке. Затем растворы фильтруют, остатки добавленных оксидов и гидроксидов промывают, сушат и используют вновь. Полученные растворы MgCl2, AlCl3, ZnCl2 используют в лаборатории. Раствор FeCl2 и FeCl3 в пробирке с железом помещают в нейтрализатор. Медь из раствора соляной кислоты фильтрованием отделяют от кислоты. Медь и кислоту используют вновь.
б) Вытеснение металла из раствора соли другим металлом
Оборудование: Три пробирки, штатив для пробирок, шпатель, разбавленные растворы: нитрата свинца (II), сульфата меди, нитрата серебра; металлы: цинк, железо, медь (в виде предметов).
Ход работы: В одну пробирку наливают раствор нитрата свинца, во вторую – сульфата меди, в третью – нитрата серебра. В первую пробирку опускают кусочек цинка, во вторую железный гвоздь и в третью – медную проволоку. Через некоторое время в первой пробирке обнаруживаются блестящие, рыхлые кристаллы свинца; во второй пробирке – хлопья меди и в третьей – блестящее, серебряное покрытие. Написать соответствующие уравнения реакций, сделать выводы.
Техника безопасности: Вымыть тщательно руки при попадании растворов солей свинца, меди, серебра.
Утилизация. Отделить кусочки металлов от растворов солей, очистить от осажденных на них свинца, меди и серебра механически, металлы использовать вновь. Растворы солей использовать многократно, поместив их в соответствующие склянки с этикеткой: PbNO3 + ZnNO3; CuSO4 + FeSO4; AgNO3 + Cu (NO3)2.
Опыт № 4. Химическая коррозия
Вариант (а): Оборудование: Тигельные щипцы, спиртовка, спички, медная и железная пластинки, наждачная бумага.
Ход работы: С помощью наждачной бумаги хорошо очищают медную и железную пластинки. Каждую из них берут тигельными щипцами и нагревают в течение 2-3 мин. в пламени спиртовки. Медная пластинка покрывается темным налетом (CuO), а железная – окалиной (Fe 3O4). При повышенной температуре происходит взаимодействие металлов с кислородом воздуха – процесс химической коррозии.
Вариант (б): Оборудование: Тигельные щипцы, спиртовка, спички, медная пластинка, молоток.
Ход работы: Складывают вдвое тонкую медную пластину и сплющивают ее молотком (особенно тщательно по краям). Пластинку берут тигельными щипцами и нагревают в пламени спиртовки до образования темного налета оксида меди. Когда пластинка остынет, ее разворачивают и рассматривают. Внутри пластинки черного оксида меди нет, т.к. эта часть пластинки не соприкасалась с кислородом воздуха.
Опыт № 5. Электрохимическая коррозия
1. Оборудование и реактивы: Штатив с пробирками, раствор серой кислоты (1:5), цинк (гранулы), медная проволока, шпатель.
Ход работы: В пробирку на 1/3 объема наливают раствор серной кислоты и помещают одну гранулу цинка. Наблюдают выделение газа водорода. Далее дотрагиваются до цинка медной проволокой. Реакция идет более энергично, выделяются более крупные пузырьки газа. Написать соответствующие уравнения реакций, объяснить наблюдаемые явления.
Утилизация. Использовать раствор серной кислоты в следующем опыте.
2. Оборудование и реактивы: Штатив с пробирками, раствор серой кислоты (1:5), цинк (гранулы), раствор сульфата меди массовой долей 5 %.
Ход работы: В пробирку наливают раствор серной кислоты и помешают гранулу цинка. Наблюдают выделение газа водорода. Затем в эту пробирку приливают раствор сульфата меди. Идет бурное выделение пузырьков газа. Написать соответствующие уравнения реакций, объяснить наблюдаемые явления.
Утилизация: Оставить содержимое пробирки до полного обесцвечивания раствора: Zn + CuSO4 ® Cu + ZnSO4. Отделить фильтрованием кусочек цинка с осевшей на нем медью. Промыть, высушить медь и цинк. В фильтрат (H2SO4 и ZnSO4) добавить оксида, гидроксида или карбоната цинка до прекращения их растворения в кислоте. Избыток твердых веществ отделить от раствора сульфата цинка и использовать реактивы в лаборатории.
3. Оборудование и реактивы: Химический стакан на 200 мл, крышка со вставленными в нее электродами (медным и цинковым), гальванометр, раствор серной кислоты (1:5).
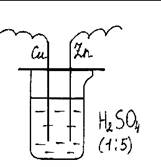
Рис. 29. Электрохимическая коррозия цинка в кислой среде.
Ход работы: В стакан наливают раствор серной кислоты и накрывают крышкой с электродами (медный и цинковый), соединяют электроды с гальванометром, стрелка гальванометра отклоняется. Описать все происходящие процессы, написать уравнения реакций.
Утилизация. Раствор серной кислоты использовать многократно.
4. Оборудование и реактивы: Два химических стакана, медный и цинковый электроды, марлевый жгутик, гальванометр, растворы хлорида меди и хлорида цинка (10 %.)
Ход работы: В один стакан наливают 10 % раствор хлорида меди, в другой – раствор хлорида цинка. В первый стакан помещают медный электрод, а во второй – цинковый. Соединяют их гальванометром. Растворы солей соединяют марлевым жгутиком, смоченным электролитом. Описать все происходящие процессы. Написать уравнения реакций.
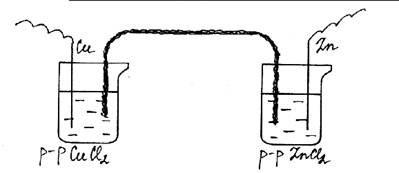
Рис. 30. Медно-цинковый гальванический элемент. Электрохимическая коррозия цинка.
Примечание: Марлевый жгутик не должен касаться электродов, для этого оба конца жгутика помещают в стеклянные трубки.
Утилизация. Растворы сливают в соответствующие склянки и используют многократно.
5.Оборудование и реактивы: Железный нож, наждачная бумага, разбавленные растворы хлорида натрия, красной кровяной соли, фенолфталеин, стакан, пипетка.
Ход работы: Железный нож очищают наждачной бумагой. Пипеткой нанести на нож несколько капель раствора-индикатора, состоящего из хлорида натрия и красной кровяной соли, смешанных в соотношении объемов 10:1, и нескольких капель фенолфталеина. Через некоторое время появляется синяя окраска в центре капли и малиновая на поверхности капли. Дать объяснение происходящим процессам, написать уравнения реакций.
Утилизация: Раствор-индикатор с красной кровяной солью использовать многократно.
Опыт № 6. Ингибирование процесса коррозии в кислой среде
Оборудование и реактивы: Штатив с пробирками, шпатель, раствор серной кислоты (1:5), уротропин (порошок или в таблетке), железные гвозди, наждачная бумага, спирт, вата.
