Простые эфиры. Краун-эфиры. Представления о межфазном катализе. Реакции простых эфиров
![]() (29)
(29)
В этих рекциях 18-краун-6 выполняет роль катализатора переноса фазы. Перенос реагента из одной фазы в другую (обычно из жидкой или твердой неорганической в жидкую органическую) называют межфазным катализом, а краун-эфиры – катализаторами межфазного переноса.
Реакции простых эфиров
Просты
е эфиры относятся к числу малореакционноспособных веществ и стабильны по отношению ко многим реагентам, особенно основной природы. Поэтому они широко используются в качестве растворителей. Сольватирующая способность эфиров как растворителей основана на их свойствах жестких оснований Льюиса. Как жесткие основания они образуют прочные комплексы с реактивами Гриньяра, литийорганическими соединениями, содержащими жесткие кислоты, _ катионы магния или лития.
Основные свойства простых эфиров
Поскольку атом кислорода обладает высокой электроотрицательностью и низкой поляризуемостью, простые эфиры являются слабыми n-основаниями Бренстеда и жесткими основаниями Льюиса. По этой же причине они способны образовывать оксониевые соли в безводной среде только с сильными кислотами Бренстеда (серной кислотой, галогеноводородами) и взаимодействовать с жесткими кислотами по Пирсону - хлоридами алюминия, цинка, олова(IV); трифторидом бора. Являясь жесткими основаниями Льюиса эфиры образуют очень прочные комплексы с жесткими кислотами Льюиса - BF3, AlBr3, AlR3, SbCl5, SbF5, SnCl4, ZnCl2 и т.д. состава 1:1 или 1:2:
Основными свойствами эфиров объясняется их хорошая растворимость в кислотах:
 (9)
(9)
диэтилоксонийхлорид
![]() (10)
(10)
диэтилоксонийтрифторборат
Как основания Льюиса эфиры образуют комплексы с галогенами, в которых эфир играет роль донора, а галоген - акцептора пары электронов. Раствор йода в эфире окрашен в коричневый цвет в отличие от фиолетовой окраски йода в алканах.
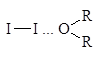 d- d+
d- d+
Такие комплексы получили название комплексов с переносом заряда (КПЗ).
Кислотное расщепление простых эфиров
Под действием галогенводородных кислот эфиры расщепляются через промежуточные оксониевые соли:
![]() (11)
(11)
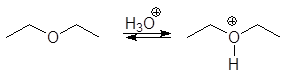 (М 4)
(М 4)
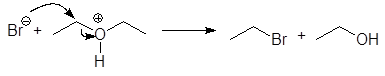
При избытке HBr спирт превращается во вторую молекулу этилбромида:
![]() (12)
(12)
избыток
Кислотное расщепление простых эфиров следует рассматривать как типичный случай реакции нуклеофильного замещения у насыщенного атома углерода. В зависимости от природы алкильных групп, связанных с кислородом, реализуется SN2- или SN1-механизм. Для расщепления требуются сильные кислоты и хорошие нуклеофилы HI (57%) и HBr (48%). Конц. HCl (38%) наименее эффективна потому что Cl- в воде является более слабым нуклеофилом, чем Br- и I-.
Особенно склонны к расщеплению третичные аллильные и бензильные эфиры. Третичный бутиловый эфир расщепляется соляной кислотой при обычной температуре по механизму SN1:
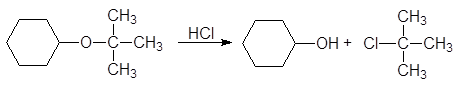 (13)
(13)
Радикальные реакции эфиров
Подобно алканам, простые эфиры вступают в реакцию радикального галогенирования, однако галогенирование эфиров отличается высокой региоселективностью и осуществляется в a-положение по отношению к атому кислорода:
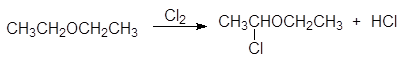 (14)
(14)
a-хлордиэтиловый эфир
Атом хлора в a-хлорэфирах очень подвижен и легко замещается.
Эфиры способны окисляться атмосферным кислородом и при долгом стоянии на воздухе в них накапливаются гидроперекиси, например:
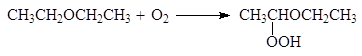 (15)
(15)
гидроперекись эфира
Перекиси разрушают натрием, солями железа (II) или марганца (II).
