Равновесия в неводных растворах
Тип связи также не может служить критерием, который лег бы в основу суждения о наличии или отсутствии взаимодействия. В самом деле, между крайними случаями — образованием чисто ковалентной или ионной связи и слабым вандерваальсовским взаимодействием — существует множество промежуточных типов, одна классификация которых подчас вызывает значительные затруднения.
Строго говоря, процесс молеку
лярной ассоциации (диссоциации) должен быть отнесен к химическому взаимодействию. Действительно, если, например, ассоциат (АН)Х через Н-связь подвергается молекулярной диссоциации, то это сопряжено с разрывом Н-связи, т. е. по всем формальным признакам (в число которых включается и весьма значительная величина энергии связи) подходит под химическое взаимодействие. Однако ассоциативно-диссоциативные процессы не принято относить к химическому взаимодействию. В противном случае пришлось бы разграничивать химическое взаимодействие, относящееся к первой стадии равновесий в растворах и межмолекулярное взаимодействие между компонентами раствора:
![]()
(предполагается для простоты, что молекулы растворителя также ассоциированы через Н-связь).
.Впрочем, вряд ли было бы целесообразным считать любое межмолекулярное взаимодействие данного типа химическим. Так, если АН и SH — соединения тождественной химической природы, стоящие к тому же близко в гомологическом ряду (например, пропанол и бутанол, изомеры крезола, валериановая и масляная кислоты и т. п.), то образование новых межмолекулярных связей (перекрестных ассоциатов) не может быть отнесено к химическому взаимодействию, хотя бы потому, что это взаимодействие практически не сопряжено с таким изменением энергетических характеристик системы, которое могло бы быть с уверенностью зафиксировано.
Выбор критерия, которым следует пользоваться для суждения о взаимодействии в химической системе, в каждый данный период развития химии зависит от развития теория, а также методов исследования химических систем. Так, в настоящее время благодаря интенсивному развитию ИК- и радиоспектроскопии, появляется возможность получения гораздо более интимных сведений о химической системе, чем два-три десятилетия назад. И несомненно, что спустя определенный промежуток времени появятся методы исследования, которые углубят степень познания процессов, протекающих в системе, столь же значительно, как это сделали упомянутые методы. Вот почему всегда, говоря о наличии или отсутствии химического взаимодействия, следует оговаривать, о какой степени приближения идет речь, так как очевидно, что универсального определения, одинаково пригодного для всех случаев, быть не может.
Хотя современные методы исследования позволяют зафиксировать весьма слабые химические взаимодействия с энергией порядка десятой доли ккал/моль, в подавляющем большинстве случаев в растворах они не могут быть с уверенностью обнаружены. Дело в том, что энергетические эффекты смешения соизмеримы, а зачастую значительно превышают указанную величину. Вот почему слабая энергетика химического взаимодействия в растворах не может быть выделена на фоне значительных тепловых эффектов смешения, а также теплового движения молекул.
В этих случаях предпочитают говорить'об отсутствии химического взаимодействия между компонентами, образующими раствор. Такая точка зрения является приближением, весьма пригодным для рассмотрения процессов, протекающих в растворах.
Таким образом, процесс химического взаимодействия между растворенным веществом АК и растворителем S
![]()
с точки зрения -представлений, которые будут соблюдаться и в этой книге, протекает не всегда. Он необходим лишь тогда, когда образуется электролитный раствор. В литературе химическое соединение (АК)mSn часто называют сольватом, а сам процесс — сольватацией. Прежде понятие «сольват» очень часто отождествляли с понятием «соединение неопределенного состава», В тех же случаях, когда стехиометрия взаимодействия между АК и S была точно известна, употребляли термин «продукт присоединения». По мере усовершенствования методов исследования растворов смысловое различие между этими двумя понятиями постепенно исчезает. В этой книге мы будем считать эти понятия синонимами, применяя, следуя традиции, укоренившейся в литературе, термин «сольватация» для обозначения процессов присоединения молекул растворителя к ионам, а термин «продукт присоединения» — для сольватов, образующихся в жидких системах. В случае ионных сольватов принято различать первичную и вторичную сольватные оболочки. При этом в первичную оболочку входит то сравнительно небольшое количество молекул растворителя, которые непосредственно связаны с ионом (причем энергия связи ион — молекула растворителя соизмерима с энергией химической связи) и которые перемещаются в растворе вместе с ионом. Вторичная сольватная оболочка включает значительно большее число молекул растворителя. Границы этой оболочки определяются изменением физико-химических характеристик растворителя под влиянием иона.
Исследование стехиометрии и глубины взаимодействия в растворах, т. е. изучение стехиометрии и константы равновесия процесса является предметом обширнейшего раздела теории растворов.
3. Ионизация
Энергетический анализ процесса электролитической диссоциации показывает, что сольват (AK)mSn не может непосредственно перейти в диссоциированные на ионы соединения. Так, продукт присоединения амина к кислоте RCOOH • NR3’ не может непосредственно дать ионы RCOO- и [NR3H]+. Для этого потребовалось бы затратить весьма значительную энергию, необходимую для разрыва связи —О-Н. Поэтому стадии электролитической диссоциации продукта присоединения амина к кислоте предшествует, стадия ионизации продукта присоединения, заключающаяся в отторжении протона от гидроксильной группы с переходом его на атом азота, причем образуется ионизированный комплекс RCOO--[NR3H]+.
В общем виде процесс ионизации передается схемой:
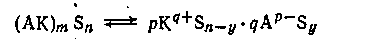
Нередко взаимодействие между компонентами раствора может ограничиваться стадией ионизации. Особенно часто это встречается в растворах с низкой диэлектрической проницаемостью. Например, при сливании разбавленных бензоловых растворов трихлоруксусной кислоты и триэтиламина образуется практически нацело ионизованный продукт присоединения, однако электропроводность раствора очень низка.
Наиболее удобным методом изучения стадии ионизации в растворах является исследование колебательных спектров. Однако константа ионизации при этом может быть рассчитана лишь тогда, когда электролитическая диссоциация протекает в малой степени, так как в подавляющем большинстве случаев на ИК-спектрах полосы поглощения, отвечающие ионам, находящимся и в свободном состоянии и в ионизованном комплексе, неразличимы.
В жидких системах информация о стадии ионизации может быть получена на основании кондуктометрических измерений.
