Скорость образования, расходования компонента и скорость реакции
![]() .
.
Уравнение для константы скорости реакции первого порядка примет вид:
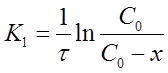 (13)
(13)
Из уравнения (13) при известной константе скорости и начальной концентрации вещества Со можно определить х в момент времени τ. Для этого преобразуем уравнение (13) к виду:
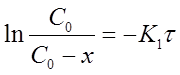
После потенцирования этого выражения получим
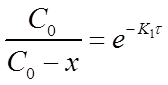
Разрешив уравнение относительно х найдем формулу для его вычисления:
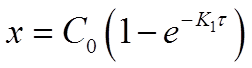
Основной задачей химической кинетики является расчет скоростей химических реакций. Их определяют из уравнения (7) по известной константе скорости. К1 находят экспериментально. При этом по экспериментальным данным изменения концентрации исходного вещества от времени строят график в координатах 1пС - τ. В этой системе координат кинетическое уравнение реакции 1го порядка (12) представляет прямую линию. Тангенс угла наклона этой линии равен К1 (см. рисунок 2).
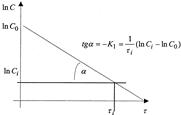
Рисунок 2 - Графическое определение константы скорости реакции 1го порядка
Иногда для характеристики скорости реакции пользуются временем полупревращения или полураспада τ1/2.
τ1/2 - это промежуток времени, в течение которого реагирует
половина взятого вещества: С = 1/2С0; С0 = 2С,
тогда
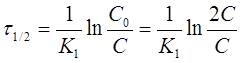
Или
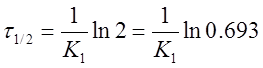
Из уравнения следует, что τ1/2 для реакции первого порядка не зависит от начальной концентрации исходного вещества и определяется только константой скорости.
Уравнения кинетики реакции 1 ого порядка характеризуют не только скорости мономолекулярных реакций, но применимы и к сложным реакциям. Многие сложные реакции протекают как реакции первого порядка.
1.4.2 Односторонние реакции 2го порядка
Это реакции вида:
А1+ А2 = Продукты.
Выражение для скорости реакции имеет вид:
W = K2C1C2, (14)
где С1 и С2 - концентрации веществ А1 и А2 в момент времени τ протекания реакции;
К2 - константа скорости реакции 2го порядка. С другой стороны скорость реакции можно представить через изменения концентрации исходных веществ во времени:
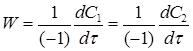 При vi = 1.
При vi = 1.
После подстановки этих соотношений в уравнение (14) получим:
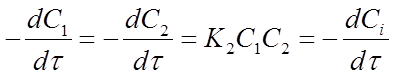 (15)
(15)
Обозначим x - уменьшение концентрации исходных веществ с течением реакции. Тогда
при τ = 0, С1 =С01, С2 =С02;
приτ > 0,С1 = С01 - х, С2= С02 - х ,
где С01 и С02 начальные концентрации веществ A1 и A2, Из равенств для времени τ > 0 в общем виде:
Сi = С0i - х, dСi =-d х.
Подставим приведенные соотношения в уравнение (15) и получим:
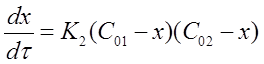
Разделим переменные в полученном выражении и проведем некоторые преобразования:
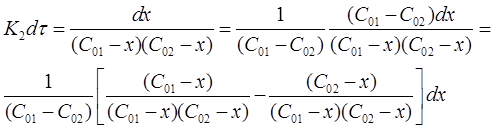
Окончательно можно записать:
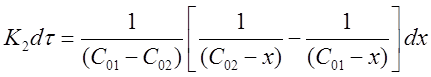
Проинтегрируем выражение в пределах от τ = 0 до τ и от х = 0 до х:
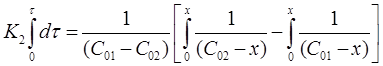
После решения интегральных выражений получим:
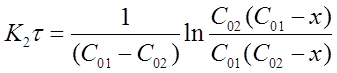
Откуда:
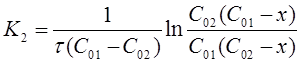 (16)
(16)
При выводе формулы для расчета К2 использовано вычисление неопределенного интеграла
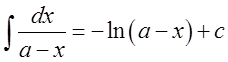
Из уравнения (16), после небольших его преобразований, можно получить выражение для расчета х .
Представим формулу (16) в виде:
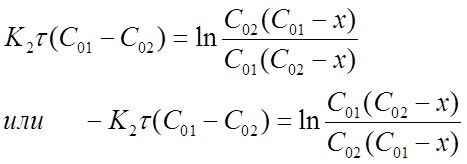
После потенцирования получим
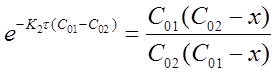
Откуда
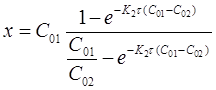
В частном случае, когда С01 = C02 = C0 уравнение скорости односторонней реакции второго порядка примет вид (при v = 1):
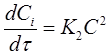 (17)
(17)
Если использовать значение х, то производная:
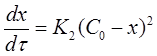 (18)
(18)
Разделим переменные в уравнениях (17) и (18), проинтегрируем первое в пределах от 0 до τ и от С0 до С, второе от 0 до τ и от 0 до х:
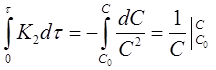
Откуда
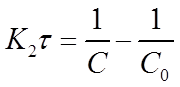 (19)
(19)
Если уравнение разрешить относительно К2, то получим:
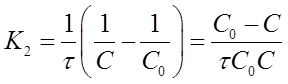
Интегрированиеуравнения (18)
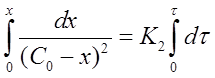
после решения для определения К2 дает формулу:
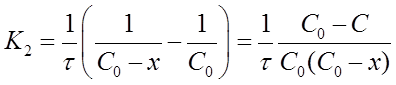
Константу скорости К2 определяют экспериментально. При этом используют уравнения (16) или (19) в виде:
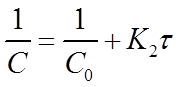
Приведенное уравнение в системе координат (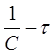 ) дает
) дает
прямую линию. Тангенс угла наклона этой линии, построенной по экспериментальным данным, равен константе скорости изучаемой реакции (рисунок 3).
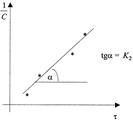
Рисунок 3 - Графическое определение константы скорости реакции второго порядка
1.4.3 Односторонние реакции 3го порядка
Это реакции вида:
3А → Продукты или А1 + А2+ А3 → Продукты.
Для скорости первой реакции справедливо соотношение:
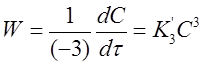
Откуда
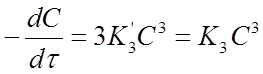
Где К3 =3К’3
Если концентрации исходных веществ СА1 =СА2 =СА3=С в любой момент времени, то кинетическое уравнение скорости второй реакции имеет вид:
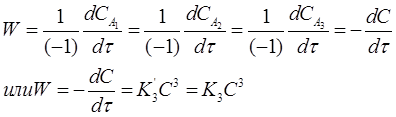 (20)
(20)
где K3 = К’3 .
Разделим переменные в уравнении (20) и проинтегрируем его в пределах от 0 до τ и от С0 до С
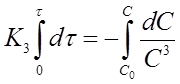
И получим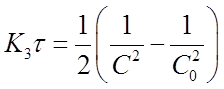
Если это равенство разрешить относительно К3, то найдем формулу для вычисления константы скорости реакции третьего порядка:
