Устойчивость дисперсных систем, седиментация и диффузия
Например, для золя AgCl, стабилизированного хлоридом калия, коагулирующем действием обладают катионы. Например, большой коагулирующей способностью обладает четырёхзарядный ион тория Th4+. Однако если взять для коагуляции смесь Th(NO3)4 и K2SO4, то коагулирующая способность этой смеси значительно меньше, чем отдельно взятого Th(NO3)4. Связано это с тем, что в результате химической реакции образу
ется комплекс:
![]()
и вместо четырёхзарядных ионов Th4+ в золе будут находиться однозарядные катионы K+, коагулирующее действие которых значительно слабее (правило Шульце-Гарди).
Гетероадагуляция - прилипание частиц дисперсной фазы к вводимой в систему чужеродной поверхности.
Одной из причин этого явления является адсорбция стабилизатора на этой поверхности. Например: отложение коллоидных частиц на волокнах при крашении и дроблении.
Для гидрофобных золей в качестве ВМС обычно используют белки, углеводы, пектины; для неводных золей – каучуки.
При введении в коллоидный раствор электролитов, содержащих многовалентные ионы с зарядом противоположные заряду частиц, наблюдается явление «неправильные ряды». Оно состоит в том, что при добавлении к отдельным порциям золя все возрастающего его количества электролита золь сначала остается устойчивым, затем в определенном интервале концентраций происходит коагуляция; далее золь снова становится устойчивым и, наконец, при повышении концентрации электролита опять наступает коагуляция уже окончательная. Подобные явления могут вызывать и большие органические ионы. Объясняется это тем, что при весьма малых количествах введенного электролита ионов недостаточно, чтобы коагулировать золь, т. е. значение x- потенциала остается выше привычного (рис. 3.1.2.4). При больших количествах электролита его ионы проявляют коагулирующее действие. Этот интервал концентраций отвечает значениям x- потенциала частиц от x критического первого знака до x критического другого знака.
 При еще больших концентрациях многовалентные ионы перезаряжают коллоидную частицу и золь опять устойчивый. В этой зоне x-потенциал опять выше критического значения, но обратен по знаку частицам исходного золя. Наконец, при высоком содержании исходного электролита многовалентные ионы снова снижают значение x-потенциала ниже критического и снова происходит окончательная коагуляция.
При еще больших концентрациях многовалентные ионы перезаряжают коллоидную частицу и золь опять устойчивый. В этой зоне x-потенциал опять выше критического значения, но обратен по знаку частицам исходного золя. Наконец, при высоком содержании исходного электролита многовалентные ионы снова снижают значение x-потенциала ниже критического и снова происходит окончательная коагуляция.
Повышение агрегативной устойчивости золя путём введения в него высокомолекулярного соединения (ВМС) называется коллоидной защитой. Происходит образование защитной пленки на поверхности золя (гидратной или ВМС), препятствующей взаимодействию частиц электролита.
В качестве количественной характеристики коагуляции Зигмонди предложил использовать скорость коагуляции.
Скорость коагуляции u - это изменение концентрации коллоидных частиц в единицу времени при постоянном объеме системы.
![]() ,
,
где n - концентрация частиц;
t - время.
Знак «-» стоит потому, что концентрация частиц со временем уменьшается, а скорость всегда положительна.
Степень коагуляции a:
![]() ,
,
где Z - общее число столкновений частиц в единицу времени; Zэф - число эффективных столкновений (т.е. столкновений, приводящих к коагуляции) в единицу времени.
Если a = 0, коагуляция не происходит, коллоидный раствор агрегативно устойчив.
Если a = 1, происходит быстрая коагуляция, т.е. каждое столкновение частиц приводит к их слипанию.
Если 0 < a < 1, наблюдается медленная коагуляция, т.е. только некоторые столкновения частиц приводят к их слипанию.
Чтобы частицы при столкновении слиплись, а не разлетелись как упругие шары, должен быть преодолен потенциальный барьер коагуляции ΔUк. Следовательно, коагуляция произойдет только в том случае, когда коллоидные частицы будут обладать кинетической энергией, достаточной дл преодоления этого барьера. Для увеличения степени коагуляции необходимо снижать потенциальный барьер. Это может быть достигнуто добавлением к золю электролита – коагулянта.
Зависимость скорости коагуляции от концентрации электролита представлена на рис. 3.1.2.5.
На графике видны три участка:
I. ![]() .
.
Следовательно, кинетическая энергия kТ << ΔUк, (k – постоянная Больцмана) – лиофобный золь агрегативно устойчив.
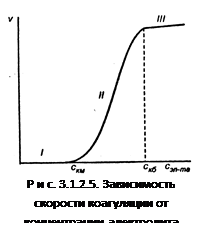 II.
II. ![]() , т.е. потенциальный барьер коагуляции больше, но соизмерим с кинетической энергией коллоидных частиц, причем с увеличением концентрации электролита – коагулянта он уменьшается, а скорость коагуляции возрастает. Скм – порог медленной коагуляции, Скб – порог быстрой коагуляции. Этот участок кривой выражает зависимость:
, т.е. потенциальный барьер коагуляции больше, но соизмерим с кинетической энергией коллоидных частиц, причем с увеличением концентрации электролита – коагулянта он уменьшается, а скорость коагуляции возрастает. Скм – порог медленной коагуляции, Скб – порог быстрой коагуляции. Этот участок кривой выражает зависимость:
На этом участке происходит медленная коагуляция.
III. ![]()
Каждое столкновение приводит к слипанию частиц – идет быстрая коагуляция.
Теория быстрой коагуляции, разработанная М. Смолуховским в 1916 г., основана на следующих положениях.
1. Рассматриваемая система является монодисперсной, радиус частиц r.
2. ![]() , т.е. все столкновения являются эффективными.
, т.е. все столкновения являются эффективными.
3. Рассматриваются только столкновения первичных частиц.
4. Кинетика коагуляции подобна кинетике бимолекулярной реакции:
![]() ,
,
где k – константа скорости коагуляции.
Проинтегрируем это уравнение, разделив переменные:
![]()
![]() ,
,
где u0 – концентрация частиц золя в начальный момент времени;
ut – концентрация частиц золя в момент времени t.
Для характеристики быстрой коагуляции используется период коагуляции(период половинной коагуляции) q.
