Методические особенности изучения темы "Атомы. Молекулы" в школьном курсе химии
Люди давно догадывались о том, что вещества состоят из отдельных мельчайших частиц. Их называют атомами. Во многих случаях атомы не существуют по одиночке, а объединяются в группы - молекулы. Атомы и молекулы чрезвычайно малы: в любом крошечном кусочке вещества, который мы в состоянии разглядеть (например, в пылинке) содержится больше атомов, чем звезд во всей нашей Галактике.
По сравнени
ю с многообразием веществ число атомов весьма ограничено. Атомы могут различным образом соединяться друг с другом. Как из букв алфавита можно составить сотни тысяч слов, так из одних и тех же атомов образуются молекулы или кристаллы огромного количества различных веществ, из которых состоит окружающий мир.
Молекула - это наименьшая частица вещества, определяющая его свойства и способная к самостоятельному существованию. Молекулы построены из атомов.
Вещество (например, сахар) можно размолоть на самой тонкой мельнице и все равно каждая крупинка будет состоять из огромного количества одинаковых молекул сахара и сохранит все известные нам свойства этого вещества. Даже если раздробить вещество на отдельные молекулы, как это происходит при растворении сахара в воде, то вещество продолжает существовать и проявлять свои свойства (в этом легко убедиться, попробовав раствор на вкус). Значит, самостоятельно существующая молекула сахара - это еще вещество под названием "сахар" (пусть даже очень маленькое количество этого вещества). Но если продолжить дробление дальше, то придется разрушить молекулы. А разрушив молекулы или даже отняв у них по паре атомов (из трех десятков, составляющих молекулу сахара!), мы уже разрушаем само вещество. Конечно, атомы никуда не исчезают - они начинают входить в состав каких-то других молекул. Но сахар как вещество при этом перестает существовать - он превращается в какие-то другие вещества.
Вещества не вечны, потому что не вечны их молекулы. Зато атомы практически вечны. В каждом из нас, возможно, найдется какое-то количество атомов, существовавших еще во времена динозавров. Или участвовавших в походах Александра Македонского, или в плавании Колумба, или побывавших при дворе Ивана Грозного.
Несмотря на то, что молекулы очень малы, их устройство можно выяснить различными физическими и химическими методами. Чистое вещество состоит из молекул одного вида. Если физическое тело содержит молекулы нескольких видов, то мы имеем дело со смесью веществ. Понятия "чистый" в химии и в быту неодинаковы. Например, когда мы говорим: -"Какой чистый воздух!" - то на самом деле вдыхаем сложную смесь нескольких газообразных веществ. Химик скажет о лесном воздухе: "Нужно серьезно поработать, чтобы выделить из этой смеси чистые вещества". Интересно, что в атмосфере любого из них по отдельности человек существовать бы не смог. В таблице 1-1 приведено соотношение этих газообразных веществ в свежем лесном воздухе.
Таблица 1-1. Состав атмосферного воздуха в сосновом лесу.
|
Вещество |
% по объему |
Вещество |
% по объему |
|
азот |
77% |
вода (пар) |
0 - 2% |
|
кислород |
21% |
озон |
7·10-6 % |
|
аргон |
0,93% |
терпинеол |
следы |
|
углекислый газ |
0,03% |
В таблице 1-1 азот, кислород, аргон и т.д. - это отдельные вещества. Вещество азот состоит из молекул азота, всем известное вещество вода - из молекул воды, терпинеол состоит из молекул терпинеола. Молекулы этих веществ могут быть очень разными - от простейших, состоящих из двух-трех атомов (азот, кислород, озон, углекислый газ) - до молекул, состоящих из многих атомов (такие молекулы встречаются в живых организмах). Например, терпинеол, который образуется в хвойных деревьях и придает воздуху запах свежести.
Это означает, что веществ, как и видов молекул, может быть бесконечное множество. Никто не может назвать точное число веществ, известных людям сегодня. Можно лишь ориентировочно сказать, что таких веществ - более семи миллионов. Это означает, что человечеству известно устройство примерно семи миллионов молекул.
Устройство и состав молекул можно описывать разными способами, например так, как это сделано на рис. 1-1, где атомы имеют вид шариков.
Атомы в молекулах разных веществ связаны друг с другом в строго определенном порядке, установление которого - одно из самых интересных занятий в работе химика. Размеры шариков имеют физический смысл и примерно соответствуют относительным размерам атомов. Те же самые вещества могут быть изображены иначе - с помощью химических символов. Издавна за каждым видом атомов в химии закреплен символ из латинских букв. В таблице 1-2 приведены символические записи веществ, изображенных на рис. 1-1. Такие символические записи называются химическими формулами.
Таблица 1-2. Химические формулы веществ из рис. 1-1. Цифра ниже символа показывает, сколько атомов данного вида содержится в молекуле. Эта цифра называется индексом. По традиции индекс "1" никогда не пишут. Например, вместо С1О2 пишут просто: СО2.
|
Вещество |
Формула |
Вещество |
Формула |
|
азот |
N2 |
вода |
H2O |
|
кислород |
O2 |
озон |
O3 |
|
аргон |
Ar |
терпинеол |
C10H18O |
|
углекислый газ |
CO2 |
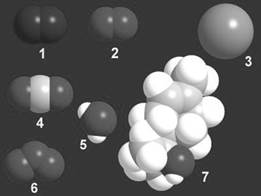
Рис. 1-1. Модели молекул и названия веществ, входящих в состав лесного воздуха: 1 - азот, 2 - кислород, 3 - аргон, 4 - углекислый газ, 5 - вода, 6 - озон (образуется из кислорода при грозовых разрядах), 7 - терпинеол (выделяется хвойными деревьями)
Существует условное деление веществ на простые и сложные. Молекулы простых веществ состоят из атомов одного вида. Примеры: азот, кислород, аргон, озон. Молекулы сложных веществ составлены из атомов двух и более видов: углекислый газ, вода, терпинеол.
Часто физическое тело состоит из молекул нескольких разных веществ. Такое физическое тело называется смесью. Например, воздух - смесь нескольких простых и сложных веществ. Не нужно путать сложное вещество со смесью. Сложное вещество, если оно состоит из молекл только одного вида, смесью не является.
Другие рефераты на тему «Педагогика»:
Поиск рефератов
Последние рефераты раздела
- Тенденции развития системы высшего образования в Украине и за рубежом: основные направления
- Влияние здоровьесберегающего подхода в организации воспитательной работы на формирование валеологической грамотности младших школьников
- Характеристика компетенций бакалавров – психологов образования
- Коррекционная программа по снижению тревожности у детей младшего школьного возраста методом глинотерапии
- Формирование лексики у дошкольников с общим недоразвитием речи
- Роль наглядности в преподавании изобразительного искусства
- Активные методы теоретического обучения
