Электричество и магнетизм
7. Выбрать линейный участок полученного графика, определить численное значение коэффициента С и вычислить угловой коэффициент n по формуле:
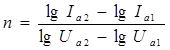
для двух любых точек линейного участка.
8. Сравнить полученное значение углового коэффициента с показателем степени в формуле (5).
Контрольные вопросы
1. Электронная эмиссия, ее виды. Работа выхода
2. Вольт-амперная характеристика вакуумного диода.
3. Закон Богуславского-Ленгмюра.
4. Каковы причины отклонения от закона Богуславского-Ленгмюра в реальных электронных лампах.
5. Зависимость тока насыщения от температуры, формула Ричардсона-Дэшмена.
6. Электронная лампа как выпрямитель.
7. Как определить поток и плотность потока электронов из катода?
8. Методика проведения эксперимента.
Литература, рекомендуемая к лабораторной работе:
1. Матвеев А.Н. Электричество и магнетизм.- М.: Высшая школа, 1983.
2. Калашников С.Г. Электричество. – М.: Наука, 1977.
3. Савельев И.В. Курс общей физики. Т.2, Т. 3. – М.: Наука, 1977.
4. Телеснин Р.В., Яковлев В.Ф. Курс физики. Электричество.-М.: Просвещение, 1970.
5. Сивухин Д.В. Общий курс физики. Т.3. Электричество.- М.: Физматлит МФТИ, 2002.
6. Иродов И.Е. Электромагнетизм. Основные законы. –М.- С.-П.: Физматлит Невский диалект, 2001
7. Зильберман Г.Е. Электричество и магнетизм. – М.: Наука, 1970.
8. Парсел Э. Курс физики Т.2 Электричество и магнетизм – М.: Наука, 1971.
9. Рублев Ю.В., Куценко А.Н., Кортнев А.В. Практикум по электричеству. – М.: Высшая школа, 1971.
ЛАБОРАТОРНАЯ РАБОТА № 8
ИЗУЧЕНИЕ ЭЛЕКТРОПРОВОДНОСТИ ЖИДКОСТИ.
Цель работы:
Экспериментальное изучение законов протекания тока через электролит. Определение числа Фарадея, заряда электрона, коэффициента диффузии, подвижности и скорости ионов.
Идея эксперимента
Для визуализации движения ионов используется водный раствор перманганата калия (KMnO4) малой концентрации. Измеряя перемещение фиолетовых ионов MnO4 можно определить их скорость υ и подвижность b, зависимость этих величин от напряженности поля Е, в котором находятся ионы. В измеряемые величины вносит вклад диффузия ионов MnO4 в растворе KNO3. Проводя измерения с полем и без поля можно определить коэффициент диффузии D и учесть его вклад в величины![]() υ и b.
υ и b.
Измерив массу вещества, выделившегося на электроде, можно определить число Фарадея F и заряд электрона e.
Теоретическая часть.
Вещества, в которых при прохождении тока происходят химические превращения, называются проводниками второго рода или электролитами. К их числу принадлежат растворы солей, щелочей или кислот в воде и некоторых других жидкостях, а также расплавы солей, являющихся в твердом состоянии ионными кристаллами
Носителями тока в электролитах служат ионы, на которые диссоциируют (расщепляются) в растворе молекулы растворенного вещества. Образовавшиеся ионы начинают странствовать по раствору. Если ионы разных знаков сблизятся на достаточно малое расстояние, они могут объединиться снова в молекулу. Этот процесс, противоположный процессу диссоциации, называется рекомбинацией или молизацией ионов. В растворе идут одновременно оба процесса. Когда количество молекул, диссоциирующих в единицу времени, станет равным количеству молекул, возникающих за то же время вследствие рекомбинации, установится равновесное состояние. Этому состоянию соответствует определенная степень диссоциации, которую принято характеризовать коэффициентом диссоциации α, показывающим, какая часть молекул растворенного вещества находится в диссоциированном состоянии.
Пусть в каждой единице объема раствора имеется n молекул растворенного вещества, из которых α∙ n диссоциировано, а (1-α) n – не диссоциированы. Количество элементарных актов диссоциации в одну секунду в единице объема тем больше, чем больше имеется в наличии нерасщепленных молекул, т.е. равно:
η1= А(1-α)n,
где А – коэффициент, зависящий от природы электролита и его температуры. Число актов рекомбинации пропорционально числу соударений разноименных ионов, которое пропорционально концентрации положительных и концентрации отрицательных ионов, т.е. равно:
η2= B(nα)2.
В состоянии равновесия η1= η2
А(1-α)n= B(nα)2,
откуда:
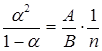 .
.
Полученная формула выражает закон Оствальда, показывающий, как зависит коэффициент диссоциации α от концентрации раствора n.
Если ввести в электролит два электрода (металлических или угольных), соединенных с полюсами источника постоянного напряжения, и создать постоянное внешнее электрическое поле, то под действием электрических сил ионы в растворе придут в направленное движение. К аноду будут двигаться отрицательные ионы (анионы), к катоду — положительные ионы (катионы).
Достигнув электродов, ионы разряжаются: анионы отдают аноду свои избыточные электроны, катионы восстанавливаются на катоде. Например, молекулы медного купороса CuSO4 диссоциируют при растворении на положительные ионы Си++ и отрицательные ионы SO4- - . Кроме ионов Си++ и ионов SO4- -, раствор содержит также водородные (Н + ) и гидроксильные (ОН-) ионы воды.
Ионы меди Си++ разряжаются легче, чем ионы водорода Н+, поэтому при прохождении тока на катоде будет происходить выделение меди
Cu++ + 2e = Cu.
Ионы SO4- - —труднее разряжаются, чем ионы ОН-. Поэтому при прохождении тока у анода разряжаются ионы гидроксила и выделяется кислород
2ОН--2е = Н2О +О, 2О → О2
Ионы SO4- - — с ионами Н+ образуют у анода раствор серной кислоты
![]()
Иначе протекает процесс, если анод изготовлен из меди. В этом случае разряд ионов происходит только у катода; у анода же, наоборот, ионы металла переходят в раствор.
Объяснить это можно тем, что атомы меди Си теряют электроны легче, чем ионы ОН-, в этом случае вместо выделения кислорода будет происходить переход с анода в раствор ионов Cu+ +
Си-2е = Си+ + .
Следовательно, электролиз CuSO4 при медном аноде сводится к переносу меди с анода на катод. В то же время количество медного купороса в растворе остается неизменным. Прохождение постоянного электрического тока через электролиты сопровождается выделением составных частей этих веществ на электродах. Это явление называется электролизом.
Явление электролиза было тщательно исследовано Фарадеем, который установил на опыте два основных закона электролиза:
Согласно первому закону Фарадея, масса m вещества, выделившаяся на каком-либо из электродов, пропорциональна величине заряда q, прошедшего через электролит:
Другие рефераты на тему «Физика и энергетика»:
Поиск рефератов
Последние рефераты раздела
- Автоматизированные поверочные установки для расходомеров и счетчиков жидкостей
- Энергосберегающая технология применения уранина в котельных
- Проливная установка заводской метрологической лаборатории
- Источники радиации
- Исследование особенностей граничного трения ротационным вискозиметром
- Исследование вольт-фарадных характеристик многослойных структур на кремниевой подложке
- Емкость резкого p-n перехода
